
【题目】下列有关电解质溶液中粒子浓度关系正确的是( )
A.一定物质的量浓度的Na2S溶液中:2c(Na+)=c(S2-)+c(H2S)+c(HS-)
B.在常温下,向0.01molL-1的NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
C.0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH)
D.等物质的量浓度的NH4HSO4溶液和NH4Cl溶液,c(NH4+)前者小
【答案】B
【解析】
A选项,一定物质的量浓度的Na2S溶液中,根据物料守恒得出:c(Na+)=2c(S2-)+2c(H2S)+2c(HS-),故A错误;
B选项,常温下,向0.01molL-1的NH4HSO4溶液中滴加NaOH溶液至中性,NaOH首先与NH4HSO4电离出的H+作用,因为H+结合OH-的能力比NH4+结合OH-的能量强,当加入等物质的量的NaOH时,正好将H+中和,此时![]() ,但此时溶液中还有NH4+,NH4+水解使溶液呈酸性,因此要使溶液呈中性,则还需继续滴入NaOH,当然到中性时c(H+) = c(OH-),c(Na+)>c(SO42-)>c(NH4+),溶液中离子浓度大小为:
,但此时溶液中还有NH4+,NH4+水解使溶液呈酸性,因此要使溶液呈中性,则还需继续滴入NaOH,当然到中性时c(H+) = c(OH-),c(Na+)>c(SO42-)>c(NH4+),溶液中离子浓度大小为:
c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故B正确;
C选项,0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,溶液中溶质实际为CH3COONa,其质子守恒为:c(OH-) = c(H+)+c(CH3COOH)。故C错误;
D选项,等物质的量浓度的NH4HSO4溶液和NH4Cl溶液,由于NH4HSO4电离出氢离子,对铵根离子水解起抑制作用,而NH4Cl中铵根水解,铵根离子浓度减小,因此前者(NH4+)大,故D错误;
综上所述,答案为B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组试利用镁铝合金废料(不含其它杂质)制备硫酸铝晶体,其实验流程如下:
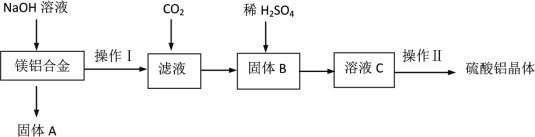
(1)在镁铝合金中加入NaOH溶液,发生反应的化学方程式为_________,固体B的化学式________。
(2)向滤液中通入足量二氧化碳的离子方程式_______________
(3)操作Ⅱ包含的实验步骤有:________、冷却结晶、过滤、洗涤、干燥。
(4)若初始时称取的镁铝合金废料的质量为7.65 g,得到固体A的质量为3.6 g,硫酸铝晶体的质量为49.95 g(假设每一步的转化率均为100%)。计算所得硫酸铝晶体的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
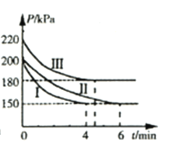
【题目】工业上用CO2和NH3合成尿素 [CO(NH2)2]。某研发小组为合成尿素进行如下实验:向5L恒容密闭容器中通入0.2molNH3和0.1molCO2,分别进行Ⅰ、Ⅱ、Ⅲ三组实验。在不同条件下发生反应:![]() ,反应体系总压强随时间的变化曲线如图所示。
,反应体系总压强随时间的变化曲线如图所示。
(1)已知:
①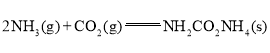
![]()
②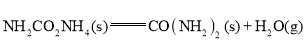
![]()
用CO2和NH3合成尿素的热化学方程式为________。
(2)Ⅰ、Ⅱ、Ⅲ三组实验中,反应温度最高的是________。(填“Ⅰ”、“Ⅱ”或“Ⅲ”)
(3)Ⅰ、Ⅲ两组实验中,NH3转化率较高的是________。(填“Ⅰ”或“Ⅲ”)
(4)若要增加实验Ⅱ的反应速率并提高NH3转化率,改变下列条件可以实现的是________(填标号)
A.增加CO2的物质的量 B.加入惰性气体使压强增大
C.升高反应的温度 D.改用2L的容器进行实验
(5)Ⅰ、Ⅱ两组实验中,反应达到平衡的时间不同,可能的原因是________。
(6)第Ⅱ组实验开始6min内NH3的平均反应速率为________![]() ,平衡常数
,平衡常数![]() ________。
________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组研究金属钾的性质。他们首先通过分析钾与钠的原子结构示意图及查阅有关资料,知道钾与钠属于同一类物质,在性质上有许多相似之处。但在金属活动性顺序表中,钾排在钠的前面,钾在空气中燃烧的产物是超氧化钾(KO2)。
(1)预测钾的化学性质,完成下列反应的化学方程式:
①钾在氯气中燃烧____________________________;
②点燃钾剧烈燃烧_____________________________;
③将小块钾投入冷水中______________________________;
(2)推测钾在自然界中的存在方式是(填“游离态”或“化合态”)________。
(3)该小组研究钾的性质时用到的主要方法有____________________________________。
(4)他们研究金属钾性质的程序是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列四种物质的溶液:①Na2CO3 ②Al2(SO4)3 ③CH3COOH ④NaHCO3。
(1)写出①溶液的电荷守恒:____________。
(2)常温下,0.1 mol·L-1④溶液的pH大于8,则溶液中c(H2CO3)_____c(CO32-)(填“>”、“=”或“<”),原因是_______(用离子方程式和必要的文字说明)。
(3)常温下0.1 mol/L的③溶液加水稀释过程中,下列表达式的数据一定变大的是_________。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(4)用②和④的溶液可以制作泡沫灭火剂,其原理为:________________(用离子方程式解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组研究金属钾的性质。他们首先通过分析钾与钠的原子结构示意图及查阅有关资料,知道钾与钠属于同一类物质,在性质上有许多相似之处。但在金属活动性顺序表中,钾排在钠的前面,钾在空气中燃烧的产物是超氧化钾(KO2)。
(1)预测钾的化学性质,完成下列反应的化学方程式:
①钾在氯气中燃烧____________________________;
②点燃钾剧烈燃烧_____________________________;
③将小块钾投入冷水中______________________________;
(2)推测钾在自然界中的存在方式是(填“游离态”或“化合态”)________。
(3)该小组研究钾的性质时用到的主要方法有____________________________________。
(4)他们研究金属钾性质的程序是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.20 mol NO和0.20 mol CO混合气体充入容积为2.0 L的恒容密闭容器中,分别在T1和T2温度下发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。反应过程中容器内CO2的物质的量随时间变化关系如图所示,下列说法正确的是
N2(g)+2CO2(g)。反应过程中容器内CO2的物质的量随时间变化关系如图所示,下列说法正确的是
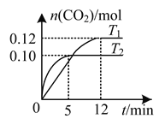
A.T1<T2
B.容器内气体的密度不再改变时反应到达平衡
C.T2温度下,该反应的平衡常数K=10
D.T1温度时,前12 min的平均反应速率v(CO)=0.01 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种钾离子电池的工作原理如图所示,下列说法正确的是
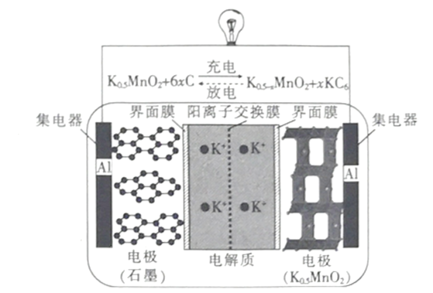
A.放电时,负极的电极反应式 :KC6 –e- =K ++6C
B.充电时,阳极的电极反应式 :K0.5-xMnO2+xK++ xe-=K0.5MnO2
C.放电时,K+ 通过阳离子交换膜向石墨电极移动
D.若仅把钾离子换成锂离子,当负极减少的质量相同时,钾离子电池转移的电子数比锂离子电池的多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com