
【题目】一种钾离子电池的工作原理如图所示,下列说法正确的是
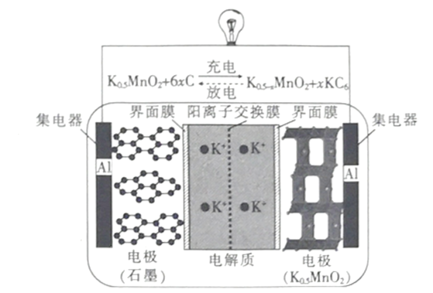
A.放电时,负极的电极反应式 :KC6 –e- =K ++6C
B.充电时,阳极的电极反应式 :K0.5-xMnO2+xK++ xe-=K0.5MnO2
C.放电时,K+ 通过阳离子交换膜向石墨电极移动
D.若仅把钾离子换成锂离子,当负极减少的质量相同时,钾离子电池转移的电子数比锂离子电池的多
【答案】A
【解析】
据图可知放电时总反应为K0.5-xMnO2+xKC6 =K0.5MnO2+6xC,该过程中K→K+被氧化,为负极,即放电时石墨电极为负极,则充电时发生还原反应为阴极;Mn元素化合价降低被还原,所以K0.5MnO2放电时为正极,充电时为阳极。
A.放电时,石墨电极为负极,附着在石墨上的K失电子被氧化成K+,结合总反应可知电极方程式为KC6 –e- =K++6C,故A正确;
B.充电时为电解池,K0.5MnO2为阳极,阳极失电子发生氧化反应,电极方程式为K0.5MnO2-xe-= K0.5-xMnO2+xK+,故B错误;
C.放电时为原电池,原电池电解质中阳离子流向正极,K0.5MnO2为正极,所以K+ 通过阳离子交换膜向K0.5MnO2电极移动,故C错误;
D.钾离子电池放电时负极反应为KC6 –e- =K++6C,锂离子电池放电时负极反应为LiC6 –e- =Li++6C,相同质量的锂和钾,锂的物质的量更大,转移的电子更多,故D错误;
故答案为A。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中粒子浓度关系正确的是( )
A.一定物质的量浓度的Na2S溶液中:2c(Na+)=c(S2-)+c(H2S)+c(HS-)
B.在常温下,向0.01molL-1的NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
C.0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH)
D.等物质的量浓度的NH4HSO4溶液和NH4Cl溶液,c(NH4+)前者小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应:
与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应:![]() 。阿伏加德罗常数的值为
。阿伏加德罗常数的值为![]() 。
。
回答下列问题:
(1)![]() 发生裂变反应:
发生裂变反应:![]() ,净产生的中子(
,净产生的中子(![]() )数为________。基态
)数为________。基态![]() 原子的外围电子排布式为
原子的外围电子排布式为![]() ,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为________(填序号)。
,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为________(填序号)。
A ![]() B
B ![]() C
C ![]() D
D ![]()
(2)![]() 和
和![]() 中,沸点较高的为________,与
中,沸点较高的为________,与![]() 形成的配离子稳定性较高的为________。
形成的配离子稳定性较高的为________。
(3)![]() 中存在大
中存在大![]() 键,形成该大
键,形成该大![]() 键的电子数为________。
键的电子数为________。
(4)某种铀氮化物的晶体结构与![]() 相同。
相同。![]() 的Bom-Haber循环如图所示。
的Bom-Haber循环如图所示。
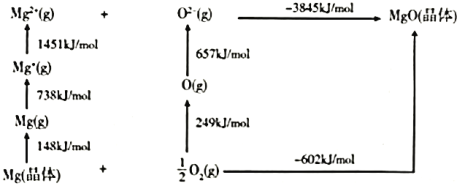
①![]() 晶格能为________
晶格能为________![]() 。
。
②![]() 的第二电离能大于
的第二电离能大于![]() 的第二电离能,是由于
的第二电离能,是由于![]() 的半径较
的半径较![]() 小、
小、![]() 的核电荷更高以及_______。
的核电荷更高以及_______。
(5)另一种铀氮化物的晶胞如下图所示,![]() “原子”作面心立方最密堆积。
“原子”作面心立方最密堆积。
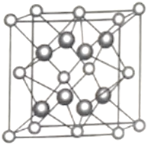
①铀元素的化合价为________,![]() “原子”的配位数为________。
“原子”的配位数为________。
②已知晶胞参数为![]() ,则晶体的密度为________
,则晶体的密度为________![]() (列出计算式)。
(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为测定Na2CO3固体(含少量NaCl)的纯度,设计如下装置(含试剂)进行实验。
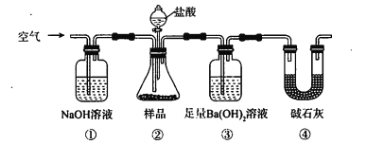
下列说法不正确的是
A. 必须在②③间添加吸收HCl的装置
B. ④的作用是防止空气中的气体影响实验的精确度
C. 通入空气的作用是保证②中产生的气体完全转移到③中
D. 称取样品和③中产生的沉淀的质量即可求算Na2CO3固体的纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.11.2 LCl2通入足量的NaOH 溶液中充分反应 ,转移的电子数为 0.5NA
B.4.4 g 由 CO2 和 N2O 组成的混合气体中含有的电子总数为 2.2NA
C.常温下 ,1.0L p H= l 的 H2SO4溶液中含有H+的数目为 0.2NA
D.11.5 g乙醇分子中含有C- H键的数目为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气中CO2浓度的持续走高引起人们的高度重视。一些科学家认为,人类不仅要努力减少CO2的排放,还要尽快想办法清除空气中过多的CO2。为此,他们设想了一系列“捕捉”和“封存” CO2的方法。
方法Ⅰ:一些科学家利用太阳能加热的反应器“捕捉”空气中的CO2,如图所示。
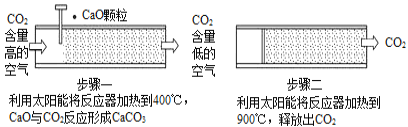
(1)步骤一中的CaO俗称____________。
(2)步骤二中发生反应的化学方程式是____________,该反应____________(填“是”或“不是”)步骤一中反应的逆反应。
方法Ⅱ:另一些科学家利用NaOH溶液的喷淋“捕捉”空气中的CO2,如图所示。
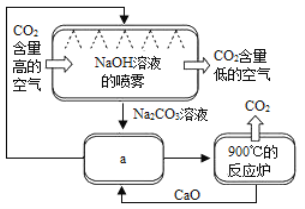
(1)NaOH溶液喷成雾状是为了_________________。
(2)上图a环节中,物质分离的基本操作是__________。
(3)为了尽量减少成本,在整个流程中,循环利用的物质有CaO和____________。
(4)下列溶液中,同样能用于“捕捉”二氧化碳的是____________。
A.KNO3溶液 B.CaCl2溶液 C.CuSO4溶液 D.Na2CO3溶液
(5)“捕捉”到的二氧化碳,一部分可以用于生产;一部分则设想注入深海中“封存”起来。但过多的二氧化碳会导致海水水质的变化,最终殃及海洋生物,其原因是_____(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制氯酸锶[Sr(ClO3)2]的实验装置如下。回答下列问题
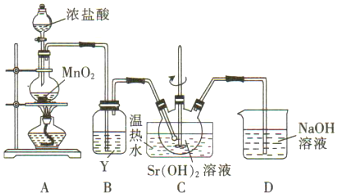
(1)装置A中浓盐酸在反应中的作用是_____.
(2)Y是_____(填字母).
A.浓H2SO4 B.饱和NaCl溶液 C.NaOH溶液
(3)装置D中NaOH溶液的作用是_____.
(4)C中反应的氧化剂与还原剂的质量比为_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 表示阿伏加德罗常数的值,工业制备硝酸的过程中发生反应
表示阿伏加德罗常数的值,工业制备硝酸的过程中发生反应![]() 。下列说法正确的是
。下列说法正确的是
A.室温下,22.4LNO2中所含原子总数为![]()
B.36g![]() 中含有
中含有![]() 键的总数为
键的总数为![]()
C.标准状况下,11.2LNO中所含电子总数为![]()
D.上述反应中,生成1mol![]() 转移电子的数目为
转移电子的数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡1.8倍,下列叙述正确的是
A.平衡向正反应方向移动B.A的转化率变大
C.D的物质的量变多D.a<c+d
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com