
【题目】制氯酸锶[Sr(ClO3)2]的实验装置如下。回答下列问题
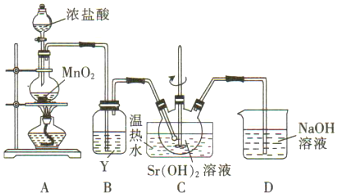
(1)装置A中浓盐酸在反应中的作用是_____.
(2)Y是_____(填字母).
A.浓H2SO4 B.饱和NaCl溶液 C.NaOH溶液
(3)装置D中NaOH溶液的作用是_____.
(4)C中反应的氧化剂与还原剂的质量比为_____.
【答案】还原性和酸性 B 吸收氯气 5:1
【解析】
(1)装置A中发生的反应为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,通过产物判断浓盐酸在反应中的作用。
MnCl2+Cl2↑+2H2O,通过产物判断浓盐酸在反应中的作用。
(2)浓盐酸易挥发,所以制得的氯气中混有氯化氢和水蒸气。
A.浓H2SO4只能吸收水蒸气;
B.饱和NaCl溶液,可吸收氯气中的氯化氢;
C.NaOH溶液,既能吸收氯化氢,又能吸收氯气;
(3)装置D中NaOH溶液的作用是尾气处理。
(4)C中发生的反应为6Cl2+6Sr(OH)2==5SrCl2+Sr(ClO3)2+6H2O,从而得出氧化剂与还原剂的质量比。
(1)装置A中发生的反应为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,反应生成Cl2,Cl元素的价态升高,HCl表现出还原性;反应生成MnCl2时,HCl表现出酸性。答案为:还原性和酸性;
MnCl2+Cl2↑+2H2O,反应生成Cl2,Cl元素的价态升高,HCl表现出还原性;反应生成MnCl2时,HCl表现出酸性。答案为:还原性和酸性;
(2)浓盐酸易挥发,所以制得的氯气中混有氯化氢和水蒸气,除杂质的目的主要是除去氯化氢。
A.浓H2SO4只能吸收水蒸气,不能去除氯化氢,A不合题意;
B.饱和NaCl溶液,可吸收氯气中的氯化氢,对氯气不产生影响,B符合题意;
C.NaOH溶液,既能吸收氯化氢,又能吸收氯气,C不合题意。答案为:B;
(3)装置D中NaOH溶液的作用是吸收氯气,防止污染环境。答案为:吸收氯气;
(4)C中发生的反应为6Cl2+6Sr(OH)2==5SrCl2+Sr(ClO3)2+6H2O,生成SrCl2的Cl2表现出氧化性,作氧化剂,生成Sr(ClO3)2的Cl2表现出还原性,作还原剂,从而得出氧化剂与还原剂的质量比5:1。答案为:5:1。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】某课外活动小组研究金属钾的性质。他们首先通过分析钾与钠的原子结构示意图及查阅有关资料,知道钾与钠属于同一类物质,在性质上有许多相似之处。但在金属活动性顺序表中,钾排在钠的前面,钾在空气中燃烧的产物是超氧化钾(KO2)。
(1)预测钾的化学性质,完成下列反应的化学方程式:
①钾在氯气中燃烧____________________________;
②点燃钾剧烈燃烧_____________________________;
③将小块钾投入冷水中______________________________;
(2)推测钾在自然界中的存在方式是(填“游离态”或“化合态”)________。
(3)该小组研究钾的性质时用到的主要方法有____________________________________。
(4)他们研究金属钾性质的程序是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究在常温下氢氧化钡晶体与氯化铵晶体反应过程中能量变化的实验方案和实验步骤如图所示,根据下面的实验方案和步骤回答下列问题:
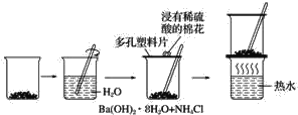
下表是某学生根据上述实验方案和步骤列表整理的实验事实和结论:
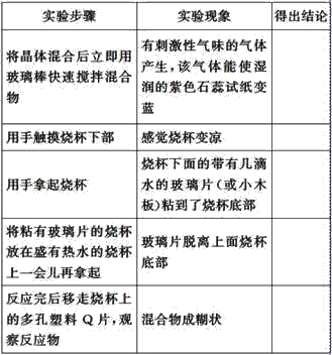
(1)请你根据实验现象得出相应的实验结论填入上表中。_________________。
(2)用化学方程式表示上述反应为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种钾离子电池的工作原理如图所示,下列说法正确的是
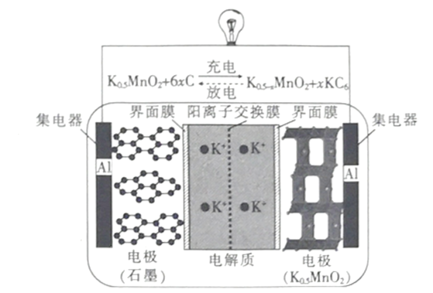
A.放电时,负极的电极反应式 :KC6 –e- =K ++6C
B.充电时,阳极的电极反应式 :K0.5-xMnO2+xK++ xe-=K0.5MnO2
C.放电时,K+ 通过阳离子交换膜向石墨电极移动
D.若仅把钾离子换成锂离子,当负极减少的质量相同时,钾离子电池转移的电子数比锂离子电池的多
查看答案和解析>>
科目:高中化学 来源: 题型:
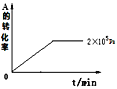
【题目】现有反应:mA(g)+nB(g)![]() pC(g)
pC(g)
(I)若达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为___热反应,且m+n__p(填“>”、“=”或“<”)。
(2)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色___;而维持容器内压强不变,充入氖气时,混合物颜色___。(填“变深”、“变浅”或“不变”)。
(II)若在容积可变的密闭容器中发生反应,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如表
压强p/Pa | 2×105 | 5×105 | 1×106 |
c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
(1)当压强从2×105Pa增加到5×105Pa时,平衡___移动(填:向左,向右,不)。
(2)维持压强为2×105Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入b molB,当重新达到平衡时,体系中气体总物质的量是___mol。
(3)当压强为1×106Pa时,此反应的平衡常数表达式:___。
(4)其他条件相同时,在上述三个压强下分别发生该反应。2×105Pa时,A的转化率随时间变化如图,请在图中补充画出压强分别为5×105Pa和1×106Pa时,A的转化率随时间的变化曲线(请在图线上标出压强)。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示:
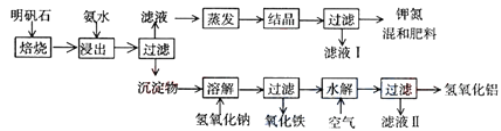
根据上述图示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出。配制500mL稀氨水(每升含有39.20g氨)需要取浓氨水(每升含有251.28g氨)__________mL,用规格为_______mL量筒量取。
(2)写出溶解步骤中反应得到的溶质为_________________(写化学式)
(3)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,请完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量______溶液,产生白色沉淀。
②___________、__________、_________(依次填写实验操作名称)。
③冷却、称重。
(4)若试样为mg,沉淀的物质的量为nmol,则试样中K2SO4的物质的量为:___________mol(用含有m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒厂用含丰富淀粉的农产品做原料经过发酵酿酒,回答下列问题:
(1)写出主要反应的化学方程式:
第一步________________________________;
第二步________________________。
(2)某酒厂生产的啤酒长时间放置产生沉淀,造成产品滞销,经化验可知沉淀物为蛋白质。为解决这一问题,提出了两种方案。
甲:在酒中加入少量蛋白酶;
乙:在酒中加入少量氨基酸氧化酶。
试评价这两种方案:
①________方案合理,原因是_______________________;
②________方案不合理,原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某课外活动小组在进行探究乙醇性质实验时遇到的问题,请你帮助解决。
(1)在做乙醇与钠反应的实验时,把一小块钠缓慢放入装有乙醇的试管内,与钠和水反应相比有所不同:①钠没有熔化成小球;②钠先沉在试管底;③反应后逐渐浮起。小组同学进行讨论,前两点现象解释达成共识。请说出你的看法:
①钠没有熔化成小球是因为_________________;
②钠先沉在试管底是因为__________________;
③第三点现象解释存在争议,活动小组的同学形成两种意见:a生成的氢气产生浮力所致;b生成的乙醇钠增大了溶液的密度所致。请你设计一个实验验证a和b说法的合理_________
(2)在做乙醇的催化氧化实验中,某同学有个意外发现:在酒精灯外焰上灼烧铜丝观察到铜丝表面变黑;当铜丝接近灯芯,变黑的铜丝又恢复原来的红色。请用化学方程式解释上述变化的过程_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以二氧化碳和氢气为原料制取乙醇的反应为2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) ΔH<0。某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示。下列说法正确的是
CH3CH2OH(g)+3H2O(g) ΔH<0。某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示。下列说法正确的是
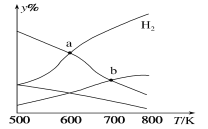
A.a点的平衡常数小于b点
B.b点,v正(CO2)=v逆(H2O)
C.a点,H2和H2O物质的量相等
D.其他条件恒定,充入更多H2,v(CO2)不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com