
【题目】将0.20 mol NO和0.20 mol CO混合气体充入容积为2.0 L的恒容密闭容器中,分别在T1和T2温度下发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。反应过程中容器内CO2的物质的量随时间变化关系如图所示,下列说法正确的是
N2(g)+2CO2(g)。反应过程中容器内CO2的物质的量随时间变化关系如图所示,下列说法正确的是
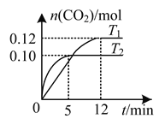
A.T1<T2
B.容器内气体的密度不再改变时反应到达平衡
C.T2温度下,该反应的平衡常数K=10
D.T1温度时,前12 min的平均反应速率v(CO)=0.01 mol·L-1·min-1
【答案】AC
【解析】
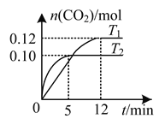
A. 由图T2先达到平衡,对应温度高,T1<T2,故A正确;
B. 气体的质量不变,体积不变,容器内气体的密度不再改变时,不能判断反应是否到达平衡,故B错误;
C. T2温度下,2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始量/mol 0.2 0.2
变化量/mol 0.1 0.1 0.05 0.1
平衡量/mol 0.1 0.1 0.05 0.1
该反应的平衡常数K=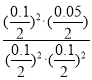 =10,故C正确;
=10,故C正确;
D. T1温度时,前12 min的平均反应速率v(CO)=(0.2-0.12)mol÷2L÷12min=0.003 33mol·L-1·min-1,故D错误;
故选AC.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】随着新能源汽车产业的快速发展,带来大量的废旧电池,一种以废旧磷酸铁锂电池正极为原料回收铝、铁和锂元素的工艺流程如下:

已知:①![]() 易溶于硫酸中。
易溶于硫酸中。
②磷酸铁锂电池正极材料:磷酸铁锂![]() ,乙炔黑(主要成分碳单质,着火点大于750℃)导电剂和有机粘结剂PVDF(一种高分子有机物),均匀混合后涂覆于铝箔上。
,乙炔黑(主要成分碳单质,着火点大于750℃)导电剂和有机粘结剂PVDF(一种高分子有机物),均匀混合后涂覆于铝箔上。
回答下列问题:
(1)破碎的作用是________,烧结的主要目的是________。
(2)碱溶发生的非氧化还原反应的离子方程式是________________。
(3)若在实验室中进行操作1、2、3,需要用到的玻璃仪器有________。
(4)滤渣1酸浸的目的是________。
(5)滤渣2主要成分是________。
(6)pH与Fe、Li沉淀率关系如下表,为使滤液2中Fe、Li分离,溶液的pH应调节为________。
溶液pH与Fe、Li沉淀率关系
pH | 3.5 | 5 | 6.5 | 8 | 10 | 12 |
Fe沉淀率 | 66.5 | 79.2 | 88.5 | 97.2 | 97.4 | 98.1 |
Li沉淀率 | 0.9 | 1.3 | 1.9 | 2.4 | 4.5 | 8.0 |
(7)碳酸锂的溶解度随温度变化如下图所示。向滤液3中加入![]() ,将温度升至90℃是为了提高沉淀反应速率和________。
,将温度升至90℃是为了提高沉淀反应速率和________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中粒子浓度关系正确的是( )
A.一定物质的量浓度的Na2S溶液中:2c(Na+)=c(S2-)+c(H2S)+c(HS-)
B.在常温下,向0.01molL-1的NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
C.0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH)
D.等物质的量浓度的NH4HSO4溶液和NH4Cl溶液,c(NH4+)前者小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铅是一种重要的化工粉末材料,被广泛用于涂料和电池等行业。湿化学法从方铅矿(主要成分为![]() )直接制取硫酸铅粉末的转化流程图如下:
)直接制取硫酸铅粉末的转化流程图如下:
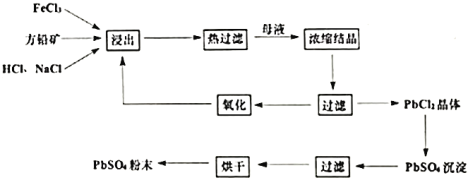
已知:①![]()
②![]()
![]()
回答下列问题:
(1)浸出过程中,产物中![]() 以
以![]() 形式存在,同时可观察到黄色沉淀,浸出过程中的反应的离子方程式为________________。反应后期,有少量气体产生,产生气体的化学方程式为________________。
形式存在,同时可观察到黄色沉淀,浸出过程中的反应的离子方程式为________________。反应后期,有少量气体产生,产生气体的化学方程式为________________。
(2)浓缩结晶过程中是将浸出液静置于冰水混合物中,从平衡角度解释使用冰水混合物的作用为________。
(3)氧化过程中通常加入![]() ,发生反应的离子方程式为__________。
,发生反应的离子方程式为__________。
(4)向![]() 固体中加入
固体中加入![]() ,发生反应的方程式为
,发生反应的方程式为![]()
![]() ,计算该反应的平衡常数为________。
,计算该反应的平衡常数为________。
(5)单位体积溶液中加入![]() 的质量对方铅矿的浸出率的影响如图,高于
的质量对方铅矿的浸出率的影响如图,高于![]() 之后,浸出率基本不变,可能的原因是_____________。
之后,浸出率基本不变,可能的原因是_____________。
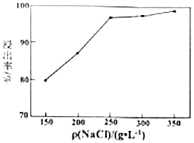
(6)传统工艺是经火法冶炼得到粗铅,然后电解精炼,再经高温熔融、氧化焙烧制取氧化铅,然后与硫酸反应制得硫酸铅。与传统工艺相比,湿化学法的优点是________(任写两点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组实验操作、现象、解释或结论均正确的是( )。
操作 | 现象 | 解释或结论 | |
A | 将石蜡油蒸汽通过炽热的碎瓷片产生的气体通入溴的四氯化碳溶液 | 溴的四氯化碳溶液逐渐褪色 | 烷烃分解产生的烯烃与溴发生了氧化反应 |
B | 将螺旋状铜丝在酒精灯上灼烧至红热插入乙醇中 | 铜丝恢复光亮的紫红色且可闻到刺激性气味 | 铜丝做催化剂,乙醇被氧化成乙醛 |
C | 将乙醇、乙酸、浓硫酸混合共热产生的蒸汽通到饱和 | 液面上有透明的不溶于水的油状液体生成,并可以闻到香味 | 浓硫酸做催化剂、加热条件下,乙醇和乙酸发生了酯化反应 |
D | 蔗糖溶液加少许稀硫酸后水浴加热几分钟,然后取少量溶液加入新制 | 未见砖红色沉淀产生 | 蔗糖尚未水解 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应:
与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应:![]() 。阿伏加德罗常数的值为
。阿伏加德罗常数的值为![]() 。
。
回答下列问题:
(1)![]() 发生裂变反应:
发生裂变反应:![]() ,净产生的中子(
,净产生的中子(![]() )数为________。基态
)数为________。基态![]() 原子的外围电子排布式为
原子的外围电子排布式为![]() ,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为________(填序号)。
,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为________(填序号)。
A ![]() B
B ![]() C
C ![]() D
D ![]()
(2)![]() 和
和![]() 中,沸点较高的为________,与
中,沸点较高的为________,与![]() 形成的配离子稳定性较高的为________。
形成的配离子稳定性较高的为________。
(3)![]() 中存在大
中存在大![]() 键,形成该大
键,形成该大![]() 键的电子数为________。
键的电子数为________。
(4)某种铀氮化物的晶体结构与![]() 相同。
相同。![]() 的Bom-Haber循环如图所示。
的Bom-Haber循环如图所示。
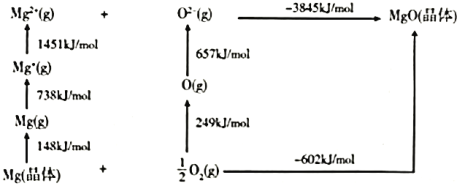
①![]() 晶格能为________
晶格能为________![]() 。
。
②![]() 的第二电离能大于
的第二电离能大于![]() 的第二电离能,是由于
的第二电离能,是由于![]() 的半径较
的半径较![]() 小、
小、![]() 的核电荷更高以及_______。
的核电荷更高以及_______。
(5)另一种铀氮化物的晶胞如下图所示,![]() “原子”作面心立方最密堆积。
“原子”作面心立方最密堆积。
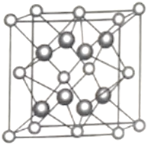
①铀元素的化合价为________,![]() “原子”的配位数为________。
“原子”的配位数为________。
②已知晶胞参数为![]() ,则晶体的密度为________
,则晶体的密度为________![]() (列出计算式)。
(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为测定Na2CO3固体(含少量NaCl)的纯度,设计如下装置(含试剂)进行实验。
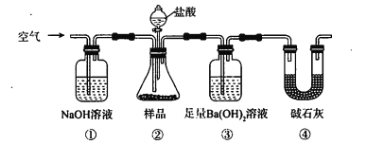
下列说法不正确的是
A. 必须在②③间添加吸收HCl的装置
B. ④的作用是防止空气中的气体影响实验的精确度
C. 通入空气的作用是保证②中产生的气体完全转移到③中
D. 称取样品和③中产生的沉淀的质量即可求算Na2CO3固体的纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 表示阿伏加德罗常数的值,工业制备硝酸的过程中发生反应
表示阿伏加德罗常数的值,工业制备硝酸的过程中发生反应![]() 。下列说法正确的是
。下列说法正确的是
A.室温下,22.4LNO2中所含原子总数为![]()
B.36g![]() 中含有
中含有![]() 键的总数为
键的总数为![]()
C.标准状况下,11.2LNO中所含电子总数为![]()
D.上述反应中,生成1mol![]() 转移电子的数目为
转移电子的数目为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com