
【题目】下列各组实验操作、现象、解释或结论均正确的是( )。
操作 | 现象 | 解释或结论 | |
A | 将石蜡油蒸汽通过炽热的碎瓷片产生的气体通入溴的四氯化碳溶液 | 溴的四氯化碳溶液逐渐褪色 | 烷烃分解产生的烯烃与溴发生了氧化反应 |
B | 将螺旋状铜丝在酒精灯上灼烧至红热插入乙醇中 | 铜丝恢复光亮的紫红色且可闻到刺激性气味 | 铜丝做催化剂,乙醇被氧化成乙醛 |
C | 将乙醇、乙酸、浓硫酸混合共热产生的蒸汽通到饱和 | 液面上有透明的不溶于水的油状液体生成,并可以闻到香味 | 浓硫酸做催化剂、加热条件下,乙醇和乙酸发生了酯化反应 |
D | 蔗糖溶液加少许稀硫酸后水浴加热几分钟,然后取少量溶液加入新制 | 未见砖红色沉淀产生 | 蔗糖尚未水解 |
A.AB.BC.CD.D
【答案】B
【解析】
A.将石蜡油蒸汽通过炽热的碎瓷片产生的气体通入溴的四氯化碳溶液,烷烃分解产生的烯烃与溴发生加成反应,使溴的四氯化碳溶液逐渐褪色,故A错误;
B.将螺旋状铜丝在酒精灯上灼烧至红热,铜被空气中氧气氧化生成氧化铜,氧化铜在加热的条件下与乙醇发生氧化反应生成铜和乙醛,反应的实质铜丝做催化剂,乙醇在加热条件下被空气中氧气氧化成乙醛,故B正确;
C.乙酸乙酯在氢氧化钠溶液中发生水解反应,不可能在氢氧化钠溶液的液面上观察到透明的不溶于水的油状液体,故C错误;
D.葡萄糖在碱性条件下才能与新制氢氧化铜共热反应生成砖红色的氧化亚铜沉淀,则蔗糖溶液加少许稀硫酸后水浴加热几分钟,应先加入足量的氢氧化钠溶液中和硫酸,使溶液呈碱性后,再加入新制氢氧化铜并加热,才能观察到砖红色沉淀,若不加入足量的氢氧化钠溶液中和硫酸,不能判断蔗糖是否水解,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】下列根据实验操作及现象所得出的结论正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 测定等浓度的 | 前者pH比后者大 | 非金属性:S>C |
B | 将NaCl晶体分散在乙醇中,用激光笔照射 | 出现光亮的通路 | 该分散系为胶体 |
C | 向溶液中加入盐酸酸化的 | 产生白色沉淀 | 溶液中含有 |
D | 向填充有经硫酸处理的 | 固体由橙色变为绿色 | 乙醇具有氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列四种物质的溶液:①Na2CO3 ②Al2(SO4)3 ③CH3COOH ④NaHCO3。
(1)写出①溶液的电荷守恒:____________。
(2)常温下,0.1 mol·L-1④溶液的pH大于8,则溶液中c(H2CO3)_____c(CO32-)(填“>”、“=”或“<”),原因是_______(用离子方程式和必要的文字说明)。
(3)常温下0.1 mol/L的③溶液加水稀释过程中,下列表达式的数据一定变大的是_________。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(4)用②和④的溶液可以制作泡沫灭火剂,其原理为:________________(用离子方程式解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种短周期元素A、B、C、D,它们的核电荷数依次增大。A与C,B与D分别是同主族元素。B、D质子数之和是A、C质子数之和的2倍。这四种元素中A、C、D的单质均可在B的单质中燃烧。
(1)A的元素名称是________,C的元素符号是________。
(2)D元素位于元素周期表的第______周期第______族。
(3)C元素的单质在B的单质中燃烧的产物的化学式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.20 mol NO和0.20 mol CO混合气体充入容积为2.0 L的恒容密闭容器中,分别在T1和T2温度下发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。反应过程中容器内CO2的物质的量随时间变化关系如图所示,下列说法正确的是
N2(g)+2CO2(g)。反应过程中容器内CO2的物质的量随时间变化关系如图所示,下列说法正确的是
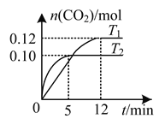
A.T1<T2
B.容器内气体的密度不再改变时反应到达平衡
C.T2温度下,该反应的平衡常数K=10
D.T1温度时,前12 min的平均反应速率v(CO)=0.01 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是地球表面最丰富的金属之一,其合金、化合物具有广泛用途。
⑴Fe3+可以与SCN-、CN-、有机分子等形成配合物。基态Fe3+的电子排布式为______;与SCN-互为等电子体且为非极性分子的化学式为______。
⑵化合物FeCl3是棕色固体、易潮解、100℃左右时升华,它的晶体类型是______。
⑶普鲁士蓝俗称铁蓝,结构如图甲所示(K+未画出),平均每两个立方体中含有一个K+,该晶体的化学式为______。又知该晶体中铁元素有+2价和+3价两种,则Fe3+与Fe2+的个数比为______。
⑷在一定条件下铁形成的晶体的基本结构单元如图乙和图丙所示,则图乙和图丙的结构中铁原子的配位数之比为______,两种晶体中空间利用率较高的是______。(填“图乙”或“图丙”)
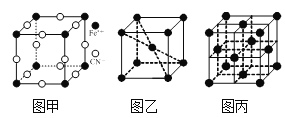
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸氨柔比星是临床主要用于治疗癌症的药物。F是合成盐酸氨柔比星的三种中间体之一,其合成路线如下:

⑴化合物D的分子式为C12H14O2,请写出D的结构简式:______。
⑵写出同时满足下列条件的B的一种同分异构体的结构简式:_____。
Ⅰ.能发生银镜反应,且能与FeCl3溶液发生显色反应;
Ⅱ.分子中含有4种不同化学环境的氢。
⑶请写出以 为原料制备
为原料制备![]() 的合成路线(无机试剂任选)。合成路线流程例见本题题干。____________________
的合成路线(无机试剂任选)。合成路线流程例见本题题干。____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(如图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,已知0-t1时,原电池的负极是Al片,反应过程中有红棕色气体产生。下列说法不正确的是

A. 0-t1时,正极的电极反应式为:2H++ NO3- - e-=NO2+ H2O
B. 0-t1时,溶液中的H+ 向Cu电极移动
C. t1时,负极的电极反应式为:Cu–2e-= Cu2+
D. t1时,原电池中电子流动方向发生改变是因为Al在浓硝酸中钝化,氧化膜阻碍了Al的进一步反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示的实验装置制取乙酸乙酯。回答以下问题:
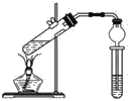
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是先向试管中加入一定量的________,然后边振荡边缓缓加入________,冷却后再加入一定量的________,轻轻振荡使之混合均匀。
(2)浓硫酸的作用是__________________________
(3)饱和碳酸钠溶液的作用是__________________________
(4)生成的乙酸乙酯,其密度比水________(填“大”或“小”),有________味。
(5)与书中采用的实验装置的不同之处是本实验采用了球形干燥管代替了长导管,并将干燥管的末端插入了饱和碳酸钠溶液中。在此处球形干燥管的作用有________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com