
����Ŀ������ͼ��ʾ��ʵ��װ����ȡ�����������ش��������⣺
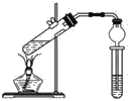
��1���ڴ��Թ�������һ���������Ҵ��������Ũ����Ļ��Һ�ķ����������Թ��м���һ������________��Ȼ�����������________����ȴ���ټ���һ������________��������ʹ֮��Ͼ��ȡ�
��2��Ũ�����������__________________________
��3������̼������Һ��������__________________________
��4�����ɵ��������������ܶȱ�ˮ________(������������С��)����________ζ��
��5�������в��õ�ʵ��װ�õIJ�֮ͬ���DZ�ʵ����������θ���ܴ����˳����ܣ���������ܵ�ĩ�˲����˱���̼������Һ�С��ڴ˴����θ���ܵ�������________��
���𰸡��Ҵ� Ũ���� ���� ��������ˮ�� ���������������ܽ�ȣ��ܽ������Ҵ������� С ���� ʹ��������������Һ��ֽӴ�����ֹ��������
��������
��ʵ������ӦΪ��CH3COOH+ C2H5OH![]() CH3COOC2H5+ H2O��ҩƷ����˳���ȼ����Ҵ����ټ���Ũ���ᡢ���������ᣬ���Ⱥ�����Ӧ��ʵ��Ӧ�������ٷ�Ӧ��Ͳ������ʧ����ʱ�����������������߲��ʡ����ʵ�鼰�л�����֪ʶ�ɽ��С�⡣
CH3COOC2H5+ H2O��ҩƷ����˳���ȼ����Ҵ����ټ���Ũ���ᡢ���������ᣬ���Ⱥ�����Ӧ��ʵ��Ӧ�������ٷ�Ӧ��Ͳ������ʧ����ʱ�����������������߲��ʡ����ʵ�鼰�л�����֪ʶ�ɽ��С�⡣
(1)ʵ���������������ķ�Ӧ�У�Ӧ�Ƚ��ܶ�С���е�͵��Ҵ������Թܣ��ٻ�������Ũ���ᣬ�ɷ�ֹҺ��ɽ����ˣ�����ȴ���ټ������ᣬ�ɼ�����ʧ����Ϊ���Ҵ���Ũ������
(2)Ũ���������֮һ������������߷�Ӧ���ʣ�ͬʱ�����շ�Ӧ���ɵ�ˮ��ʹ��Ӧ������Ӧ������У���߲��ʡ���Ϊ����������ˮ����
(3)���������ֲ�Ʒ�к����Ҵ������ᣬ�Ҵ�����ˮ��ȥ�������������������ļ�������ת��Ϊ�ζ�����ˮ��Һ�������������룬��������ǿ���Ϊ���������ڼ���ǿ����Һ����ˮ�⣬���ñ���̼������Һ��ȥ���ʣ�ͬʱҲ�ܽ��������������ܽ�ȣ������ڷֲ㡣��Ϊ�����������������ܽ�ȣ��ܽ������Ҵ������
(4)�����ܶ�һ���ˮС��������ˮ���ͼ�������ζ����Ϊ��С�����㣻
(5)����ʵ�飬����ĩ�˲���̼������Һ�Ӵ����ɷ�����������ȴЧ���ϲ���������Ļӷ����϶ࡣ��ʵ����õ��õĸ���ܣ���ʹĩ�˲�����Һ�У���ʹ��ȴЧ�����ã�ͬʱ�����ø���ܵĴ����������������á���Ϊ��ʹ��������������Һ��ֽӴ�����ֹ����������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���ʵ������������ͻ���۾���ȷ���ǣ� ����
���� | ���� | ���ͻ���� | |
A | ��ʯ��������ͨ�����ȵ����Ƭ����������ͨ��������Ȼ�̼��Һ | ������Ȼ�̼��Һ����ɫ | �����ֽ������ϩ�����巢����������Ӧ |
B | ������״ͭ˿�ھƾ��������������Ȳ����Ҵ��� | ͭ˿�ָ��������Ϻ�ɫ�ҿ��ŵ��̼�����ζ | ͭ˿���������Ҵ�����������ȩ |
C | ���Ҵ������ᡢŨ�����Ϲ��Ȳ���������ͨ������ | Һ���������IJ�����ˮ����״Һ�����ɣ��������ŵ���ζ | Ũ���������������������£��Ҵ������ᷢ����������Ӧ |
D | ������Һ������ϡ�����ˮԡ���ȼ����ӣ�Ȼ��ȡ������Һ�������� | δ��ש��ɫ�������� | ������δˮ�� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������CO2Ũ�ȵij����߸��������ǵĸ߶����ӡ�һЩ��ѧ����Ϊ�������ҪŬ������CO2���ŷţ���Ҫ������취��������й����CO2��Ϊ�ˣ�����������һϵ����������������� CO2�ķ�����
������һЩ��ѧ������̫���ܼ��ȵķ�Ӧ�������������е�CO2����ͼ��ʾ��
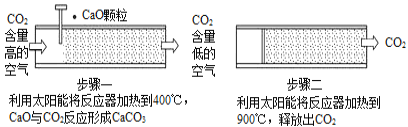
��1������һ�е�CaO�׳�____________��
��2��������з�����Ӧ�Ļ�ѧ����ʽ��____________���÷�Ӧ____________��������������������������һ�з�Ӧ���淴Ӧ��
��������һЩ��ѧ������NaOH��Һ�����������������е�CO2����ͼ��ʾ��
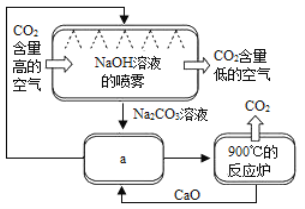
��1��NaOH��Һ�����״��Ϊ��_________________��
��2����ͼa�����У����ʷ���Ļ���������__________��
��3��Ϊ�˾������ٳɱ��������������У�ѭ�����õ�������CaO��____________��
��4��������Һ�У�ͬ��������������������̼����____________��
A��KNO3��Һ B��CaCl2��Һ C��CuSO4��Һ D��Na2CO3��Һ
��5�����������Ķ�����̼��һ���ֿ�������������һ����������ע������������������������Ķ�����̼�ᵼ�º�ˮˮ�ʵı仯�������꼰���������ԭ����_____���û�ѧ����ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ij��ѧ�о���ѧϰС��ģ�ҵ�ϳɰ��ķ�Ӧ�����ݻ��̶�Ϊ2L���ܱ������ڳ���1molN2��3mol H2��������ʴ���(������Ժ��Բ���)����һ���¶�ѹǿ�¿�ʼ��Ӧ������ѹ���Ƽ��������ѹǿ�ı仯���£�
��Ӧʱ�� /min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
ѹǿ /MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
��ӷ�Ӧ��ʼ��25 minʱ����N2��ʾ��ƽ����Ӧ���ʣ�____��
��2����ҵ�ϳɰ��ķ�Ӧ����ʽΪ��N2(g)+3H2(g)![]() 2NH3(g) ��H����ͼ1�Ǻϳɰ���Ӧ�������뷴Ӧ�������ͼ��δʹ�ô�������ͼ2�Ǻϳɰ���Ӧ��2L�����С���ͬͶ������¡���������������ʱ��ijһ��Ӧ�����ĸı�Է�Ӧ��Ӱ��ͼ��
2NH3(g) ��H����ͼ1�Ǻϳɰ���Ӧ�������뷴Ӧ�������ͼ��δʹ�ô�������ͼ2�Ǻϳɰ���Ӧ��2L�����С���ͬͶ������¡���������������ʱ��ijһ��Ӧ�����ĸı�Է�Ӧ��Ӱ��ͼ��

����˵����ȷ������_____��
A.��H=-92.4kJ/mol
B.ʹ�ô�����ʹE1����ֵ����
C.Ϊ�����ת���ʣ���ҵ�����з�Ӧ���¶�Խ��Խ��
D.ͼ���Dz�ͬѹǿ�·�Ӧ��ϵ�а������ʵ����뷴Ӧʱ���ϵͼ����PA<PB
E.ͼ���Dz�ͬ�¶��·�Ӧ��ϵ�а������ʵ����뷴Ӧʱ���ϵͼ����TA>TB
F.�÷�Ӧ��ƽ�ⳣ��KA<KB
G.������A�����£���Ӧ�ӿ�ʼ��ƽ�⣬����N2��ƽ������Ϊn1/(4t1) mol/(L.min)
��3��һ���¶��£���һ���ݻ�Ϊ2L���ܱ�������ͨ��2molN2��7molH2���ﵽƽ��ʱ��������ڵ�ѹǿΪ��ʼʱ��7/9��������¶��µ�ƽ�ⳣ��Ϊ___����ͬһ�¶ȣ�ͬһ�����У�����ʼ���ʸ�ΪamolN2��bmolH2��cmolNH3��a��b��c����Ϊ�㣩��ʹƽ�������и����ʵ�������ԭƽ����ͬ����a��b��c����Ĺ�ϵΪ____���ú�a��b��c�ı���ʽ��ʾ��������ʹ��Ӧ����ʼʱ���淴Ӧ������У�c��ȡֵ��Χ��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ��ʾ�����ӵ�������ֵ����ҵ�Ʊ�����Ĺ����з�����Ӧ
��ʾ�����ӵ�������ֵ����ҵ�Ʊ�����Ĺ����з�����Ӧ![]() ������˵����ȷ����
������˵����ȷ����
A.�����£�22.4LNO2������ԭ������Ϊ![]()
B.36g![]() ���
�к���![]() ��������Ϊ
��������Ϊ![]()
C.��״���£�11.2LNO��������������Ϊ![]()
D.������Ӧ�У�����1mol![]() ת�Ƶ��ӵ���ĿΪ
ת�Ƶ��ӵ���ĿΪ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�鲻�ܴﵽʵ��Ŀ�ĵ���
A | B | C | D | |
ʵ�� |
|
|
|
|
ʵ��Ŀ�� | ʵ������ȡ���� | ֤����Ȳ��ʹ��ˮ��ɫ | �������ǵ�ˮ�������л�ԭ�� | ֤���ܽ�ȣ� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������и�˵���У���ȷ����
A.��H��0��ʾ���ȷ�Ӧ����H��0��ʾ���ȷ�Ӧ
B.�Ȼ�ѧ����ʽ�еĻ�ѧ������ֻ��ʾ���ʵ����������Ƿ���
C.��֪C(s)+![]() O2(g)=CO(g) ��H=-110.5kJ��mol-1��˵��̼��ȼ����Ϊ110.5kJ��mol-1
O2(g)=CO(g) ��H=-110.5kJ��mol-1��˵��̼��ȼ����Ϊ110.5kJ��mol-1
D.1molH2��0.5molO2��Ӧ�ų����Ⱦ���H2��ȼ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС������ͼװ�ã�֧��������ȥ��̽���Ҵ��Ĵ�������Ӧ��
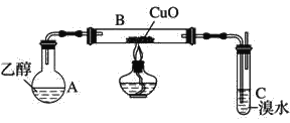
��1��ʵ�鿪ʼʱ����A����ˮԡ���ȣ���Ŀ����__��
��2��B�з�Ӧ����ʽΪ__��
��3����װ��C�п�ʼ�������������ȡ��Ӧ����ʩ��__�����ţ���
a����ȥͼ�еľƾ��� b����C����Ƥ���γ�
c����Bβ�˵��齺��ȡ�� d����A��B֮����齺��ȡ��
��4��̽������ַ�Ӧ�۲쵽��ˮ��ȫ��ɫ��ѧϰС��ͨ���ⶨ��Ӧǰ��ˮ��n��Br2���뷴Ӧ����Һ��n��Br������ȷ����ȩʹ��ˮ��ɫ��ԭ��
�ټ��裺��д������1�ķ�Ӧ���͡�
����1��CH3CHO+Br2��CH2BrCHO+HBr__��
����2��CH3CHO+Br2��CH3CHBrOBr �ӳɷ�Ӧ��
����3��CH3CHO+Br2+H2O��CH3COOH+2HBr ������Ӧ��
�ٽ��ۣ���ʵ����n��Br2��=0.005mol��n��Br����=0.01mol����֤������__��ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ1��ͼ2��A��B�������ʵĺ˴Ź������ס������ͼ1��ͼ2�������ʵĺ˴Ź���������ͼѡ�����������ͼ1��ͼ2���������ʵķ���ʽ�� ��
ͼ1 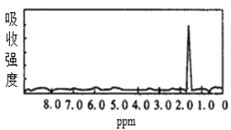 ͼ2
ͼ2 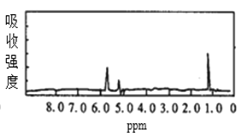
A.A��C3H6��B��C2H6B.A��C6H6��B��C4H6
C.A��C6H6��B��C2H6D.A��C3H8��B��C6H6
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com