
【题目】某学习小组用如图装置(支撑仪器略去)探究乙醇的催化氧化反应。
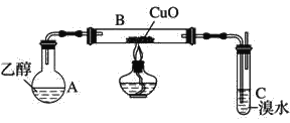
(1)实验开始时,对A进行水浴加热,其目的是__。
(2)B中反应方程式为__。
(3)若装置C中开始发生倒吸,则采取的应急措施是__(填编号)。
a.移去图中的酒精灯 b.将C中橡皮塞拔出
c.将B尾端的乳胶管取下 d.将A与B之间的乳胶管取下
(4)探究:充分反应后,观察到溴水完全褪色。学习小组通过测定反应前溴水中n(Br2)与反应后溶液中n(Br﹣)来确定乙醛使溴水褪色的原因。
①假设:请写出假设1的反应类型。
假设1:CH3CHO+Br2→CH2BrCHO+HBr__;
假设2:CH3CHO+Br2→CH3CHBrOBr 加成反应;
假设3:CH3CHO+Br2+H2O→CH3COOH+2HBr 氧化反应。
①结论:若实验测得n(Br2)=0.005mol,n(Br﹣)=0.01mol,则证明假设__正确。
【答案】产生平稳的乙醇气流 CH3CH2OH+CuO![]() CH3CHO+Cu+H2O c 取代反应 3
CH3CHO+Cu+H2O c 取代反应 3
【解析】
(1)加热时采用水浴加热可以让乙醇平稳气化成乙醇蒸气;
(2)乙醇与氧化铜反应生成乙醛、Cu与水;
(3)乙醛与溴水反应,导致装置内压强降低,发生倒吸,采取应急措施,避免C中溶液倒吸到B中而发生炸裂;
(4)①根据反应物与生成物的结构,可知乙醛甲基中的H原子被Br原子取代;
②实验测得n(Br2)=0.005mol,n(Br-)=0.01mol,则n(Br2):n(Br-)=1:2,可以确定反应是按假设3进行的;
(1)为使A中乙醇平稳气化成乙醇蒸气,常采用的方法是水浴加热;
故答案为:产生平稳的乙醇气流;
(2)乙醇与氧化铜反应得到乙醛、Cu与水,反应方程式为CH3CH2OH+CuO![]() CH3CHO+Cu+H2O;
CH3CHO+Cu+H2O;
故答案为:CH3CH2OH+CuO![]() CH3CHO+Cu+H2O;
CH3CHO+Cu+H2O;
(3)a.移去图中的酒精灯,导致B中的压强更小,倒吸更严重,故a不可行;
b.将C中的橡皮塞拔出,并没有减小大气压,并且乙醛有毒污染空气,仍然倒吸,故b不可行;
c.将B尾端的乳胶管取下,使B与C断开连接,避免C中溶液倒吸到B中而发生炸裂,故c可行;
d.将A与B之间的乳胶管取下,使B与大气相通,气压与C相同,但C中已经倒吸的溶液可能进入B中发生炸裂,故d不可行;
故答案选:c;
(4)①根据反应物与生成物的结构,可知乙醛甲基中的H原子被Br原子取代,反应取代反应;
故答案为:取代;
②实验测得n(Br2)=0.005mol,n(Br﹣)=0.01mol,则n(Br2):n(Br﹣)=1:2,乙醛与溴水的反应按假设3进行;
故答案为:3;


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(如图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,已知0-t1时,原电池的负极是Al片,反应过程中有红棕色气体产生。下列说法不正确的是

A. 0-t1时,正极的电极反应式为:2H++ NO3- - e-=NO2+ H2O
B. 0-t1时,溶液中的H+ 向Cu电极移动
C. t1时,负极的电极反应式为:Cu–2e-= Cu2+
D. t1时,原电池中电子流动方向发生改变是因为Al在浓硝酸中钝化,氧化膜阻碍了Al的进一步反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示的实验装置制取乙酸乙酯。回答以下问题:
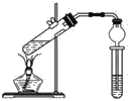
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是先向试管中加入一定量的________,然后边振荡边缓缓加入________,冷却后再加入一定量的________,轻轻振荡使之混合均匀。
(2)浓硫酸的作用是__________________________
(3)饱和碳酸钠溶液的作用是__________________________
(4)生成的乙酸乙酯,其密度比水________(填“大”或“小”),有________味。
(5)与书中采用的实验装置的不同之处是本实验采用了球形干燥管代替了长导管,并将干燥管的末端插入了饱和碳酸钠溶液中。在此处球形干燥管的作用有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(含有I2、I-等)中回收碘,其实验过程如下:
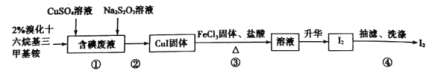
己知:溴化十六烷基三甲基铵是一种阳离子表面活性剂,可以中和沉淀表面所带的负电荷,使沉淀颗粒快速聚集,快速下沉。下列说法错误的是
A.含碘废液中是否含有IO3-,可用KI-淀粉试纸检验
B.步骤①中Na2S2O3可用Na2SO3代替
C.步骤②可以用倾析法除去上层清液
D.步骤③发生反应的离子方程式为:4Fe3++2CuI![]() 4Fe2++2Cu2++I2
4Fe2++2Cu2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬酸(用H3R表示)是一种高效除垢剂。常温时,用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的物质的量百分数随pH的变化如图所示。下列说法正确的是
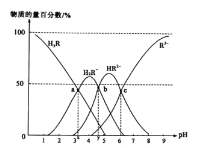
A.由a点判断H3R的第一步电离常数Ka1(H3R)的数量级为10-3
B.若b点溶液中金属阳离子只有Na+,则有c(Na+)=c(R3-)+c(HR2-)+c(H2R-)+c(H3R)
C.pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
D.反应2H2R-![]() H3R+HR2-在该温度下的平衡常数K=10x-y
H3R+HR2-在该温度下的平衡常数K=10x-y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰硫酸(NOSO4H)纯品为棱形结晶,溶于硫酸,遇水易分解,常用于制染料。制备NOSO4H的反应原理为:![]() 、
、![]() 。
。
(1)亚硝酰硫酸(NOSO4H)的制备。
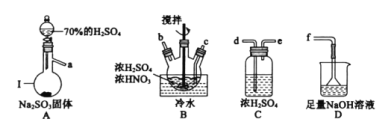
①仪器Ⅰ的名称为_________。
②按气流从左到右的顺序,上述仪器的连接顺序为____(填仪器接口字母,部分仪器可重复使用)。
③为了控制B中通入SO2的速率,可以采取的措施是_____。
④NOSO4H遇水分解的化学方程式为______,若去掉装置C会使NOSO4H的产量____(填“增大”、“减少”或“无影响”)。
(2)亚硝酰硫酸(NOSO4H)纯度的测定。
准确称取1.337g产品加入250mL碘量瓶中,加入60.00mL浓度为0.1000mol·L-1KMnO4标准溶液和10mL25%H2SO4溶液,然后摇匀。用0.2500mol·L-1Na2C2O4标准溶液滴定,消耗Na2C2O4溶液的体积20.00mL。
己知:ⅰ. ![]() + NOSO4H+
+ NOSO4H+ ![]() 、 +
、 + ![]() +
+ ![]() +
+ ![]()
ⅱ.![]()
①完成反应ⅰ的离子方程式:
____![]() +____
+____![]() ____
____![]() ____+____
____+____![]() +____
+____![]() +____
+____![]()
②滴定终点的现象为________。
③产品的纯度为_____%(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二砷(As2O3)可用于治疗急性早幼粒白血病。利用某酸性含砷废水(含![]() 、H+、
、H+、![]() )可提取三氧化二砷,提取工艺流程如下:
)可提取三氧化二砷,提取工艺流程如下:
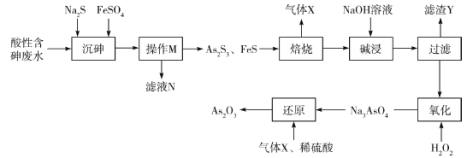
已知:①常温下,![]() ;
;![]() 。
。
②As2O3+6NaOH=2Na3AsO3+3H2O。
③As2S3易溶于过量的Na2S溶液中,故加入FeSO4的目的是除去过量的S2-。
回答下列问题:
(1)操作M的名称是________,滤液N中含有的阳离子有Fe2+、H+、________。
(2)“焙烧”操作中,As2S3参与反应的化学方程式为____________。
(3)“碱浸”的目的是_____________,“滤渣Y”的主要成分是_____________(写化学式)。
(4)“氧化”中发生反应的离子方程式为___________________。
(5)该流程中可循环使用的物质是_________(写化学式),某次“还原”过程中制得了1.98kgAs2O3,则消耗标准状况下该物质的体积是________L。
(6)溶液中金属离子的除去方法之一是Na2S沉降法。常温下,若某溶液中含Fe2+、Ag+,且浓度均为0.1mol·L-1,则向该溶液中滴加稀Na2S溶液时,先生成的沉淀是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正常人心脏在一次搏动中泵出血液约80 mL,正常人血压(可看作心脏压送血液的压强)平均值为1.6×104Pa,心跳每分钟约70次。设人类消耗体内的葡萄糖产生的热量最高可有80%(睡眠时)用来维持心脏的跳动,葡萄糖与氧气反应产生热量的化学方程式为:C6H12O6(s)+6O2(g)―→6CO2(g)+6H2O(g)(放出热量2804 kJ)
(1)心脏工作的平均功率约为______________;
(2)由于心脏跳动每天需消耗葡萄糖的质量是____________________________;
(3)维持生命每天需消耗氧气的体积是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A. 用Na2S处理含Hg2+废水:Hg2+ + S2 = HgS↓
B. 燃煤中添加生石灰减少SO2的排放:2CaO + O2 + 2SO2 ![]() 2CaSO4
2CaSO4
C. 工业上将Cl2 通入石灰乳中制漂白粉:Cl2 + OH- = Cl-+ ClO- + H2O
D. 向漂白液中加入适量洁厕灵(含盐酸),产生氯气:ClO-+ Cl-+2H+ = Cl2↑+ H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com