
°ĺŐ‚ńŅ°Ņ—«Ōűű£ŃÚňŠ£®NOSO4H£©īŅ∆∑ő™ņ‚–őĹŠĺߣ¨»‹”ŕŃÚňŠ£¨”Ųňģ“◊∑÷Ĺ‚£¨≥£”√”ŕ÷∆»ĺŃŌ°£÷∆ĪłNOSO4HĶń∑ī”¶‘≠ņŪő™£ļ![]() °Ę
°Ę![]() °£
°£
£®1£©—«Ōűű£ŃÚňŠ£®NOSO4H£©Ķń÷∆Īł°£
ĘŔ“«∆ųĘŮĶń√Ż≥∆ő™_________°£
Ęŕįī∆ÝŃųī”◊ůĶĹ”“Ķńň≥–Ú£¨…Ō Ų“«∆ųĶńѨŔň≥–Úő™____£®ŐÓ“«∆ųĹ”Ņŕ◊÷ńł£¨≤Ņ∑÷“«∆ųŅ…÷ōłī Ļ”√£©°£
ĘŘő™ŃňŅō÷∆B÷–Õ®»ŽSO2ĶńňŔ¬ £¨Ņ…“‘≤…»°ĶńīŽ © «_____°£
Ę‹NOSO4H”Ųňģ∑÷Ĺ‚ĶńĽĮ—ß∑Ĺ≥Ő Ĺő™______£¨»Ű»•ĶŰ◊į÷√CĽŠ ĻNOSO4HĶń≤ķŃŅ____£®ŐÓ°į‘Ųīů°Ī°Ę°įľű…Ŕ°ĪĽÚ°įőř”įŌž°Ī£©°£
£®2£©—«Ōűű£ŃÚňŠ£®NOSO4H£©īŅ∂»Ķń≤‚∂®°£
◊ľ»∑≥∆»°1.337g≤ķ∆∑ľ”»Ž250mLĶ‚ŃŅ∆Ņ÷–£¨ľ”»Ž60.00mLŇ®∂»ő™0.1000mol°§L£≠1KMnO4ĪÍ◊ľ»‹“ļļÕ10mL25%H2SO4»‹“ļ£¨»Ľļů“°‘»°£”√0.2500mol°§L£≠1Na2C2O4ĪÍ◊ľ»‹“ļĶő∂®£¨ŌŻļńNa2C2O4»‹“ļĶńŐŚĽż20.00mL°£
ľļ÷™£ļĘ°. ![]() + NOSO4H+
+ NOSO4H+ ![]() °Ę +
°Ę + ![]() +
+ ![]() +
+ ![]()
ĘĘ.![]()
ĘŔÕÍ≥…∑ī”¶Ę°ĶńņŽ◊”∑Ĺ≥Ő Ĺ£ļ
____![]() +____
+____![]() ____
____![]() ____+____
____+____![]() +____
+____![]() +____
+____![]()
ĘŕĶő∂®÷’Ķ„ĶńŌ÷Ōůő™________°£
ĘŘ≤ķ∆∑ĶńīŅ∂»ő™_____%£®Ī£ŃŰŃĹőĽ”––ß ż◊÷£©°£
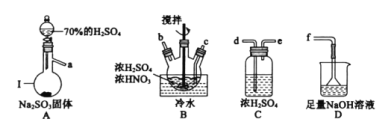
°ĺīūįł°Ņ’ŰŃů…’∆Ņ a°ķde°ķcb°ķde°ķf ĶųĹŕ◊į÷√A÷–Ķń∑÷“ļ¬©∂∑ĽÓ»Ż£¨Ņō÷∆ŃÚňŠ»‹“ļĶńĶőľ”ňŔ∂» ![]() £®∆šňŻļŌņŪīūįłĺýłÝ∑÷£© ľű…Ŕ 2 5 2
£®∆šňŻļŌņŪīūįłĺýłÝ∑÷£© ľű…Ŕ 2 5 2 ![]() 5 5 9 Ķő»Ž◊Óļů“ĽĶő
5 5 9 Ķő»Ž◊Óļů“ĽĶő![]() »‹“ļļů£¨»‹“ļ”…«≥◊Ō…ęĪšő™őř…ę«“įŽ∑÷÷”—’…ę≤ĽĽ÷łī 95
»‹“ļļů£¨»‹“ļ”…«≥◊Ō…ęĪšő™őř…ę«“įŽ∑÷÷”—’…ę≤ĽĽ÷łī 95
°ĺĹ‚őŲ°Ņ
NOSO4H”Ųňģ“◊ňģĹ‚£¨“Úīň‘ŕ÷∆ĪłĻż≥Ő÷–£¨“™∑ņ÷ĻňģĹÝ»Ž∑Ę…ķ◊į÷√°£ņŻ”√70%H2SO4ļÕNa2SO3÷∆ĪłSO2£¨SO2÷–ļ¨”–ňģ’Ű∆Ý£¨–Ť“™≥ż»•£¨ņŻ”√Ň®ŃÚňŠ≥ż»•ňģ∑÷£Ľ‘ŕB÷–∑Ę…ķ∑ī”¶£¨ņŻ”√D◊į÷√ī¶ņŪőī∑ī”¶ĶńSO2£¨ő™Ńň∑ņ÷ĻD÷–Ķńňģ’Ű∆ÝÕ®Ļż¬©∂∑ĹÝ»Ž◊į÷√B£¨BļÕD÷ģľš–Ť“™”√◊į÷√C∑ņ÷ĻňģĹÝ»ŽB°£
(1)ĘŔłýĺ›◊į÷√ĶńŐōĶ„£¨“«∆ųĘŮĶń√Ż≥∆ő™’ŰŃů…’∆Ņ£Ľ
ĘŕNOSO4H”Ųňģ“◊ňģĹ‚£¨“Úīň‘ŕ÷∆ĪłĻż≥Ő÷–£¨“™∑ņ÷ĻňģĹÝ»Ž∑Ę…ķ◊į÷√°£◊į÷√A”√”ŕ÷∆ĪłSO2£¨◊į÷√B”√”ŕ÷∆ĪłNOSO4H£¨◊į÷√D”√”ŕő≤∆ÝőŁ ’£¨ő™Ńň∑ņ÷ĻňģĹÝ»Ž◊į÷√B£¨AA°ĘB÷ģľš£¨BļÕD÷ģľš–Ť“™ľ”»Ž◊į÷√C£¨“ÚīňѨŔň≥–Úő™a°ķde°ķcb°ķde°ķf£Ľ
ĘŘő™ŃňŅō÷∆Õ®»ŽSO2ĶńňŔ¬ £¨◊į÷√A”√”ŕ÷∆ĪłSO2£¨Ņ…“‘Õ®ĻżĶųĹŕ◊į÷√A÷–∑÷“ļ¬©∂∑£¨ņīĶųĹŕŃÚňŠ»‹“ļĶńĶőľ”ňŔ∂»£¨ī”∂ÝŅō÷∆Õ®»ŽSO2ĶńňŔ¬ £Ľ
Ę‹NOSO4H”Žňģ∑ī”¶…ķ≥…HNO2ļÕH2SO4£¨ĽĮ—ß∑Ĺ≥Ő Ĺő™NOSO4H£ęH2O=H2SO4£ęHNO2£Ľ»ÁĻŻ»•ĶŰ◊į÷√C£¨≤ķőÔĺÕĽŠ”ŽĹÝ»Ž◊į÷√B÷–Ķńňģ∑ī”¶£¨ĽŠ «Ķń≤ķőÔĶńŃŅľű…Ŕ£Ľ
(2)ĘŔ‘ŕňŠ–‘ŐűľĢŌī£¨MnO4£≠÷–MnĶńĽĮļŌľŘĹĶĶÕ£¨…ķ≥…Mn2£ę£¨ĽĮļŌľŘĹĶĶÕ5ľŘ£ĽNOSO4H÷–£¨SĶńĽĮļŌľŘő™£ę6£¨OĶńĽĮļŌľŘ£≠2£¨HĶńĽĮļŌľŘ£ę1£¨‘ÚNĶńĽĮļŌľŘő™£ę3£¨NĶńĽĮļŌľŘī”£ę3…żłŖĶĹ£ę5£¨ĽĮļŌľŘ…żłŖ2£Ľłý囼ĮļŌľŘ…żĹĶ ōļ„£¨‘ÚMnO4£≠ļÕNOSO4HĶńĽĮ—ßľ∆ŃŅ ż÷ģĪ»ő™2£ļ5£¨‘Ŕłýĺ›ĶÁļ… ōļ„ļÕőÔŃŌ ōļ„£¨Ņ…Ķ√ĽĮ—ß∑Ĺ≥Ő Ĺő™2MnO4£≠£ę5NOSO4H£ę2H2O=2Mn2£ę£ę5NO3£≠£ę5SO42£≠£ę9H£ę£Ľ
Ęŕļ¨”–MnO4£≠Ķń»‹“ļĪĺ…ŪĺŖ”–—’…ę£¨ő™◊Ō…ę£Ľł’Ņ™ ľ£¨KMnO4 «ĻżŃŅĶń£¨»‹“ļĶń—’…ęő™◊Ō…ę£¨ľ”»ŽNa2C2O4»‹“ļĶő∂®ĻżŃŅĶńKMnO4£¨»‹“ļĽŠī”◊Ō…ęĪšő™őř…ę£¨“ÚīňĶő∂®÷’Ķ„ĶńŌ÷Ōůő™Ķő»Ž◊Óļů“ĽĶőNa2C2O4»‹“ļļů£¨»‹“ļ”…«≥◊Ō…ęĪšő™őř…ę«“įŽ∑÷÷”—’…ę≤ĽĽ÷łī£Ľ
ĘŘłýĺ›Ő‚“‚£¨KMnO4—űĽĮŃňNOSO4HļÕNa2C2O4£¨‘Ú”√◊‹ĶńKMnO4ľű»•—űĽĮNa2C2O4ĶńKMnO4£¨Ņ…«ůĶ√—űĽĮNOSO4HĶńKMnO4£¨ī”∂Ý«ůĶ√NOSO4HĶń÷ ŃŅ°£łý囼Į—ß∑Ĺ≥Ő Ĺ£¨Ņ…Ķ√ĻōŌĶ Ĺ2KMnO4°ę5Na2C2O5£¨‘Ú—űĽĮNa2C2O4ĶńKMnO4ĶńőÔ÷ ĶńŃŅ![]() £Ľ◊‹ĶńKMnO4ĶńőÔ÷ ĶńŃŅ
£Ľ◊‹ĶńKMnO4ĶńőÔ÷ ĶńŃŅ![]() £¨‘Ú—űĽĮNOSO4HĶńKMnO4ĶńőÔ÷ ĶńŃŅ
£¨‘Ú—űĽĮNOSO4HĶńKMnO4ĶńőÔ÷ ĶńŃŅ![]() °£łý囼Į—ß∑Ĺ≥Ő Ĺ£¨Ņ…Ķ√ĻōŌĶ Ĺ2KMnO4°ę5NOSO4H£¨‘ÚNOSO4HĶńőÔ÷ ĶńŃŅ
°£łý囼Į—ß∑Ĺ≥Ő Ĺ£¨Ņ…Ķ√ĻōŌĶ Ĺ2KMnO4°ę5NOSO4H£¨‘ÚNOSO4HĶńőÔ÷ ĶńŃŅ![]() £¨NOSO4HĶń÷ ŃŅ
£¨NOSO4HĶń÷ ŃŅ![]() £¨NOSO4HĶńīŅ∂»
£¨NOSO4HĶńīŅ∂»![]() °£
°£


 ÓľŔŌőĹ”ĹŐ≤ń∆ŕń© ÓľŔ‘§Ōįőšļļ≥Ųįś…ÁŌĶŃ–īūįł
ÓľŔŌőĹ”ĹŐ≤ń∆ŕń© ÓľŔ‘§Ōįőšļļ≥Ųįś…ÁŌĶŃ–īūįł ľŔ∆ŕ◊ų“Ķ ÓľŔ≥…≥§ņ÷‘į–¬Ĺģ«ŗ…ŔńÍ≥Ųįś…ÁŌĶŃ–īūįł
ľŔ∆ŕ◊ų“Ķ ÓľŔ≥…≥§ņ÷‘į–¬Ĺģ«ŗ…ŔńÍ≥Ųįś…ÁŌĶŃ–īūįł
| ńÍľ∂ | łŖ÷–Ņő≥Ő | ńÍľ∂ | ≥ű÷–Ņő≥Ő |
| łŖ“Ľ | łŖ“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű“Ľ | ≥ű“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ∂Ģ | łŖ∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű∂Ģ | ≥ű∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ»ż | łŖ»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű»ż | ≥ű»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° |
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅŌ¬Ń– Ķ—ťŌ÷Ōů”Ž Ķ—ť≤Ŕ◊ų≤ĽŌŗ∆•ŇšĶń «
Ķ—ť≤Ŕ◊ų | Ķ—ťŌ÷Ōů | |
A | ŌÚFe( NO3)2 ”ŽKSCN ◊ť≥…ĶńĽžļŌ»‹“ļ÷–Ķő»Ž…ŔŃŅŌ°—őňŠ | »‹“ļ—’…ę≤ĽĪš |
B | ŌÚŌ°šŚňģ÷–Õ®»Ž◊„ŃŅ SO2∆ÝŐŚ | »‹“ļĶń≥»…ę÷ūĹ•Õ »•£¨◊Ó÷’ő™őř…껋“ļ |
C | ŌÚ–¬÷∆¬»ňģ÷–ľ”»Ž…ŔŃŅ ĮĽ“ Į | »‹“ļĶń«≥Ľ∆¬Ő…ę÷ūĹ•Õ »• |
D | ĹęīÚń•Ļ‚ŃŃĶń¬Ń∆¨∑Ň÷√‘ŕĺ∆ĺęĶ∆Õ‚—ś…Ōľ”»» | ¬Ń∆¨÷ūĹ•»ŘĽĮĶę≤ĽĶő¬š |
A.AB.BC.CD.D
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅŌ¬Ń– Ķ—ť≤Ľń‹īÔĶĹ Ķ—ťńŅĶńĶń «
A | B | C | D | |
Ķ—ť |
|
|
|
|
Ķ—ťńŅĶń | Ķ—ť “÷∆»°įĪ∆Ý | ÷§√ų““»≤Ņ… ĻšŚňģÕ …ę | ľž—ť’ŠŐ«ĶńňģĹ‚≤ķőÔĺŖ”–ĽĻ‘≠–‘ | ÷§√ų»‹Ĺ‚∂»£ļ |
A.AB.BC.CD.D
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņń≥”–ĽķőÔĶń∑÷◊” Ĺő™C6H6£¨»ň√«»Ōő™ňŁ «“Ľ÷÷≤ĽĪ•ļÕŐĢ°£
£®1£©»Űł√ŐĢ∑÷◊”÷–ļ¨”–ŐľŐľ»żľŁ«“őřň꾣°Ęőř÷ßŃīĶńŃīŐĢ£¨∆šĹŠĻĻĻ≤”–__÷÷°£
£®2£©1866ńÍŅ≠Ņ‚ņ’ŐŠ≥ŲŃňĪĹĶńĶ•°Ęň꾣ż՜Ķń’żŃýĪŖ–ő∆Ĺ√śĹŠĻĻ£¨Ĺ‚ ÕŃňĪĹĶń≤Ņ∑÷–‘÷ £¨ĶęĽĻ”–“Ľ–©ő Ő‚…–őīĹ‚ĺŲ£¨ňŁ≤Ľń‹Ĺ‚ ÕŌ¬Ń– ¬ Ķ_(ŐÓ–ī–ÚļŇ)°£
ĘŔĪĹ≤Ľń‹ ĻňŠ–‘łŖ√ŐňŠľō»‹“ļÕ …ę ĘŕĪĹń‹”Ž«‚∆Ý∑Ę…ķľ”≥…∑ī”¶
ĘŘšŚĪĹ√Ľ”–Õ¨∑÷“žĻĻŐŚ Ę‹Ńŕ∂ĢšŚĪĹ÷Ľ”–“Ľ÷÷
£®3£©ĪĹ∑÷◊”ĶńŅ’ľšĻĻ–Õő™__£ĽŌ÷īķĽĮ—ß»Ōő™ĪĹ∑÷◊”ŐľŐľ÷ģľšĶńľŁ «__°£
£®4£©ĪĹ≤Ľń‹ ĻšŚňģÕ …ę£¨–‘÷ ņŗň∆ÕťŐĢ£¨–ī≥ŲĪĹĶńŌűĽĮ∑ī”¶ĶńĽĮ—ß∑Ĺ≥Ő Ĺ__°£
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņń≥—ßŌį–°◊ť”√»ÁÕľ◊į÷√£®÷ß≥Ň“«∆ų¬‘»•£©ŐĹĺŅ““īľĶńīŖĽĮ—űĽĮ∑ī”¶°£
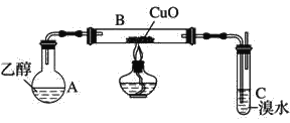
£®1£© Ķ—ťŅ™ ľ Ī£¨∂‘AĹÝ––ňģ‘°ľ”»»£¨∆šńŅĶń «__°£
£®2£©B÷–∑ī”¶∑Ĺ≥Ő Ĺő™__°£
£®3£©»Ű◊į÷√C÷–Ņ™ ľ∑Ę…ķĶĻőŁ£¨‘Ú≤…»°Ķń”¶ľĪīŽ © «__£®ŐÓĪŗļŇ£©°£
a£ģ“∆»•Õľ÷–Ķńĺ∆ĺęĶ∆ b£ģĹęC÷–Ōū∆§»Żįő≥Ų
c£ģĹęBő≤∂ňĶń»ťĹļĻ‹»°Ō¬ d£ģĹęA”ŽB÷ģľšĶń»ťĹļĻ‹»°Ō¬
£®4£©ŐĹĺŅ£ļ≥š∑÷∑ī”¶ļů£¨ĻŘ≤žĶĹšŚňģÕÍ»ęÕ …ę°£—ßŌį–°◊ťÕ®Ļż≤‚∂®∑ī”¶«įšŚňģ÷–n£®Br2£©”Ž∑ī”¶ļů»‹“ļ÷–n£®Br©Ā£©ņī»∑∂®““»© ĻšŚňģÕ …ęĶń‘≠“Ú°£
ĘŔľŔ…Ť£ļ«Ž–ī≥ŲľŔ…Ť1Ķń∑ī”¶ņŗ–Õ°£
ľŔ…Ť1£ļCH3CHO+Br2°ķCH2BrCHO+HBr__£Ľ
ľŔ…Ť2£ļCH3CHO+Br2°ķCH3CHBrOBr ľ”≥…∑ī”¶£Ľ
ľŔ…Ť3£ļCH3CHO+Br2+H2O°ķCH3COOH+2HBr —űĽĮ∑ī”¶°£
ĘŔĹŠ¬Ř£ļ»Ű Ķ—ť≤‚Ķ√n£®Br2£©=0.005mol£¨n£®Br©Ā£©=0.01mol£¨‘Ú÷§√ųľŔ…Ť__’ż»∑°£
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅņŻ”√√ļĽĮĻ§ňýĶ√ĶńĪĹŅ…ļŌ≥…ľ◊ĪĹ°Ę““ĪĹ°ĘĽ∑ľļÕť£¨∆š∑ī”¶»ÁŌ¬£ļ
ĘŔ![]() £ęCH3Cl
£ęCH3Cl![]() (ľ◊ĪĹ)£ęHCl
(ľ◊ĪĹ)£ęHCl
ĘŕCH2===CH2£ę![]()
![]() (““ĪĹ)
(““ĪĹ)
ĘŘ![]() £ę3H2
£ę3H2![]()
Ō¬Ń–ňĶ∑®’ż»∑Ķń «(°°°°)
A.∑ī”¶ĘŔ°ĘĘŕ°ĘĘŘĺý ۔ྔ≥…∑ī”¶
B.šŚňģ÷–ľ”»ŽĪĹ£¨∂Ģ’ŖŅ…∑Ę…ķ»°īķ∑ī”¶
C.““ĪĹ÷–ňý”–Őľ‘≠◊”“Ľ∂®‘ŕÕ¨“Ľ∆Ĺ√ś…Ō
D.ń‹”√šŚňģŇ–∂Ō∑ī”¶ĘŕňýĶ√Ķń““ĪĹ÷– «∑ŮĽž”–““Ō©
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅÕľ÷–ĪŪ ĺ2NO£®g£©+O2£®g£©![]() 2NO2£®g£©°ųH£ľ0£¨ń‹’ż»∑∑ī”≥ł√Ņ…ńś∑ī”¶ĪšĽĮĶńÕľŌů «£®°°°°£©
2NO2£®g£©°ųH£ľ0£¨ń‹’ż»∑∑ī”≥ł√Ņ…ńś∑ī”¶ĪšĽĮĶńÕľŌů «£®°°°°£©
A. 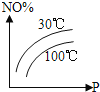 B.
B. 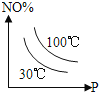
C. 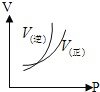 D.
D. 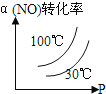
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅĹĶő¬ĹŠĺß «∑÷ņŽŌűňŠľōļÕ¬»ĽĮń∆ĽžļŌőÔĶń≥£”√∑Ĺ∑®°£Ō÷»°ŌűňŠľōļÕ¬»ĽĮń∆ĽžļŌőÔ160g£¨∑Ň»Ž100mLňģ÷–£¨ľ”»»ĶĹ80°ś£¨ĻŐŐŚ»ę≤Ņ»‹Ĺ‚°£«Žłýĺ›ŌűňŠľōļÕ¬»ĽĮń∆Ķń»‹Ĺ‚∂»«ķŌŖŇ–∂Ō£¨Ō¬Ń–ňĶ∑®’ż»∑Ķń «£®°°°°£©

A.80°ś Ī£¨»‹“ļ «ŌűňŠľōļÕ¬»ĽĮń∆ĶńĪ•ļÕ»‹“ļ
B.80°ś Ī£¨»‹“ļ÷–ŌűňŠľō≤ĽĪ•ļÕ£¨¬»ĽĮń∆Ī•ļÕ
C.ĹĶő¬ĶĹ20°ś Ī£¨őŲ≥ŲĶńĻŐŐŚ“Ľ∂® «ŌűňŠľōļÕ¬»ĽĮń∆ĶńĽžļŌőÔ
D.ĹĶő¬ĶĹ20°ś Ī£¨“Ľ∂®őŲ≥ŲŌűňŠľō£¨Ņ…ń‹őŲ≥Ų¬»ĽĮń∆
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅŌ¬Ń–“ņĺ›»»ĽĮ—ß∑Ĺ≥Ő ĹĶ√≥ŲĶńĹŠ¬Ř’ż»∑Ķń «
A.“—÷™2C(s)£ę2O2(g)=2CO2(g) ¶§H=a kJ°§mol-1£¨2C(s)£ęO2(g)=2CO(g) ¶§H=b kJ°§mol-1£¨‘Úa>b
B.“—÷™NaOH(aq)+HCl(aq)=NaCl(aq)£ęH2O(l) ¶§H= -57.3 kJ°§mol-1£¨‘Úļ¨1mol NaOHĶńŌ°»‹“ļ”Ž◊„ŃŅŌ°ī◊ňŠÕÍ»ę÷–ļÕ£¨∑Ň≥ŲĶń»»ŃŅĶ»”ŕ57.3kJ
C.“—÷™P(į◊Ń◊£¨s)=P(ļžŃ◊£¨s) ¶§H<0£¨‘Úį◊Ń◊Ī»ļžŃ◊ő»∂®
D.“—÷™H2(g)+I2(g)![]() 2HI(g) ¶§H= -a kJ°§mol-1ŌÚ√‹Ī’»›∆ų÷–ľ”»Ž2mol H2ļÕ2mol I2(g)£¨≥š∑÷∑ī”¶ļů∑Ň≥ŲĶń»»ŃŅ–°”ŕ2a kJ
2HI(g) ¶§H= -a kJ°§mol-1ŌÚ√‹Ī’»›∆ų÷–ľ”»Ž2mol H2ļÕ2mol I2(g)£¨≥š∑÷∑ī”¶ļů∑Ň≥ŲĶń»»ŃŅ–°”ŕ2a kJ
≤ťŅīīūįłļÕĹ‚őŲ>>
Ļķľ —ß–£”Ň—° - Ń∑Ōį≤ŠŃ–ĪŪ - ‘Ő‚Ń–ĪŪ
ļĢĪĪ °Ľ•Ń™ÕÝő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®∆ĹŐ® | ÕÝ…Ō”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | ĶÁ–Ň’©∆≠ĺŔĪ®◊®«Ý | …śņķ ∑–ťőř÷ų“Ś”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | …ś∆ů«÷»®ĺŔĪ®◊®«Ý
ő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®ĶÁĽį£ļ027-86699610 ĺŔĪ®” Ōš£ļ58377363@163.com