
【题目】某有机物的分子式为C6H6,人们认为它是一种不饱和烃。
(1)若该烃分子中含有碳碳三键且无双键、无支链的链烃,其结构共有__种。
(2)1866年凯库勒提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实_(填写序号)。
①苯不能使酸性高锰酸钾溶液褪色 ②苯能与氢气发生加成反应
③溴苯没有同分异构体 ④邻二溴苯只有一种
(3)苯分子的空间构型为__;现代化学认为苯分子碳碳之间的键是__。
(4)苯不能使溴水褪色,性质类似烷烃,写出苯的硝化反应的化学方程式__。
【答案】4 ①④ 平面正六边形 介于单键和双键之间的独特的键 ![]() +HO—NO2(浓)
+HO—NO2(浓)![]()
![]() +H2O
+H2O
【解析】
(1)C6H6比饱和链烃(C6H14)少8个H,如果含叁键且无双键、无支链的链烃,叁键的数目应为2个,根据叁键可能的不同位置可确定结构简式;
(2)若为苯的单、双键交替的正六边形平面结构,能与溴水发生加成反应,能使酸性高锰酸钾溶液褪色,邻二溴苯有两种;
(3)苯分子的空间构型为平面正六边形,苯分子碳碳之间的键为特殊的化学键.
(4)苯与硝酸可以发生取代反应。
(1)因为该有机物是含有碳碳三键、无双键的直链的链烃,从分子式C6H6可知,它比同碳的饱和链烃(C6H14)少8个氢原子,该烃分子中含有两个碳碳三键,可能的结构有如下4种:HC≡C—C≡C—CH2—CH3、HC≡C—CH2—C≡C—CH3、HC≡C—CH2—CH2—C≡CH、CH3—C≡C—C≡C—CH3;
故答案为4;
(2)苯不能使酸性高锰酸钾溶液褪色,说明苯分子中不含有碳碳双键,可以推测苯环结构中并不是C—C键和C=C键交替而形成;邻二溴苯只有1种结构,说明苯环结构中的6个碳碳键(只有一种)完全相同,不存在C—C键和C=C键的交替结构;
故答案选①④;
(3)苯分子的空间构型为平面正六边形,苯分子碳碳之间的键为特殊的化学键,即介于单键和双键之间的独特的键;
故答案为:平面正六边形, 介于单键和双键之间的独特的键;
(4)苯与硝酸可以发生取代反应,需要加入浓硫酸作催化剂反应方程式为:![]() +HO—NO2(浓)
+HO—NO2(浓)![]()
![]() +H2O;
+H2O;
故答案为![]() +HO—NO2(浓)
+HO—NO2(浓)![]()
![]() +H2O。
+H2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuSO4 | |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有两个碳原子的烃除乙烷、乙烯外,还有乙炔。乙炔的分子结构如下图所示。
![]()
回答下列问题:
(1)乙炔的分子式是________,结构式是________,分子空间结构是________。
(2)乙炔分子中含有________,能发生加成反应。
(3)写出下列反应的化学方程式:
①将乙炔通入足量的溴的四氯化碳溶液中________
②乙炔与等物质的量的氯化氢发生加成反应_________
(4)下列关于乙烷、乙烯、乙炔的说法中正确的是________。
①它们既不是同系物,也不是同分异构体
②乙烷是饱和烃,乙烯、乙炔是不饱和烃
③乙烯、乙炔能使溴水褪色,乙烷不能使溴水褪色
④它们都能燃烧,乙炔燃烧火焰最明亮,有浓烟
⑤它们都能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要的物质,可用于制取化肥和硝酸等。已知H-H键、N-H键、N≡N键的键能分别是436kJ/mol、391kJ/mol、946kJ/mol。
(1)写出合成氨的热反应方程式__________。生成1 mol NH3需要吸收或放出_______ kJ的热量。
(2)当合成氨反应达到平衡后,改变某一外界条件![]() 不改变N2、H2和NH3的量
不改变N2、H2和NH3的量![]() ,反应速率与时间的关系如图所示图中t1时引起平衡移动的条件可能是_______。其中表示平衡混合物中NH3的含量最高的一段时间是________。
,反应速率与时间的关系如图所示图中t1时引起平衡移动的条件可能是_______。其中表示平衡混合物中NH3的含量最高的一段时间是________。

(3)温度为T0C时,将2a molH2和a molN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%,则该反应的平衡常数为_________。
(4)已知373K时,可逆反应平衡常数为K=0.12,若某时刻时,测得c(N2)=1 mol/L,c(H2)=3 mol/L,c(NH3)=2 mol/L,此时可逆反应_________。
A.向正方向进行 B.向逆方向进行 C处于平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(含有I2、I-等)中回收碘,其实验过程如下:
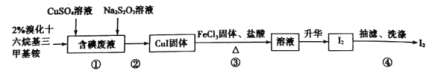
己知:溴化十六烷基三甲基铵是一种阳离子表面活性剂,可以中和沉淀表面所带的负电荷,使沉淀颗粒快速聚集,快速下沉。下列说法错误的是
A.含碘废液中是否含有IO3-,可用KI-淀粉试纸检验
B.步骤①中Na2S2O3可用Na2SO3代替
C.步骤②可以用倾析法除去上层清液
D.步骤③发生反应的离子方程式为:4Fe3++2CuI![]() 4Fe2++2Cu2++I2
4Fe2++2Cu2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产医用防护口罩的原料聚丙烯纤维属于有机高分子材料,其单体为丙烯。丙烯除了合成聚丙烯外,还广泛用于制备1,2—二氯丙烷、丙烯醛、丙烯酸等。请回答下列问题:
Ⅰ.工业上用丙烯加成法制备1,2—二氯丙烷,主要副产物为3—氯丙烯,反应原理为:
①![]()
![]()
②![]()
![]()
(1)已知![]() 的活化能
的活化能![]() (逆)为
(逆)为![]() ,则该反应的
,则该反应的![]() (正)活化能为_____
(正)活化能为_____![]() 。
。
(2)一定温度下,向恒容密闭容器中充入等物质的量的![]() 和
和![]() ,在催化剂作用下发生反应①②,容器内气体的压强随时间的变化如下表所示。
,在催化剂作用下发生反应①②,容器内气体的压强随时间的变化如下表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
用单位时间内气体分压的变化来表示反应速率,即![]() ,则反应①前180min内平均反应速率
,则反应①前180min内平均反应速率![]() ____
____![]() (保留小数点后2位)。
(保留小数点后2位)。
Ⅱ.丙烯的制备方法
方法一:丙烷无氧脱氢法制备丙烯反应如下:
![]()
![]()
(3)①某温度下,在刚性容器中充入![]() ,起始压强为10kPa,平衡时总压为14kPa,
,起始压强为10kPa,平衡时总压为14kPa,![]() 的平衡转化率为______。该反应的平衡常数
的平衡转化率为______。该反应的平衡常数![]() ______kPa(保留小数点后2位)。
______kPa(保留小数点后2位)。
②总压分别为100kPa、10kPa时发生该反应,平衡体系中![]() 和
和![]() 的物质的量分数随温度变化关系如图所示:
的物质的量分数随温度变化关系如图所示:
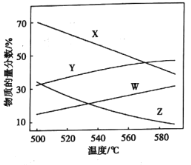
10kPa时,![]() 和
和![]() 的物质的量分数随温度变化关系的曲线分别是_____、______。
的物质的量分数随温度变化关系的曲线分别是_____、______。
方法二:丙烷氧化脱氢法制备丙烯还生成![]() 、
、![]() 等副产物,制备丙烯的反应如下:
等副产物,制备丙烯的反应如下:
![]()
![]() 。在催化剂作用下
。在催化剂作用下![]() 的转化率和
的转化率和![]() 的产率随温度变化关系如图所示。
的产率随温度变化关系如图所示。
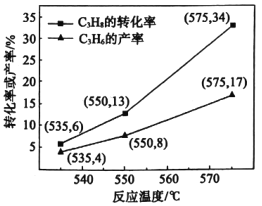
(4)①图中![]() 的转化率随温度升高而上升的原因是_________。
的转化率随温度升高而上升的原因是_________。
②575℃时,![]() 的选择性为___。(
的选择性为___。(![]() 的选择性=
的选择性=![]() )
)
③基于上述研究结果,能提高![]() 选择性的措施是______。
选择性的措施是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰硫酸(NOSO4H)纯品为棱形结晶,溶于硫酸,遇水易分解,常用于制染料。制备NOSO4H的反应原理为:![]() 、
、![]() 。
。
(1)亚硝酰硫酸(NOSO4H)的制备。
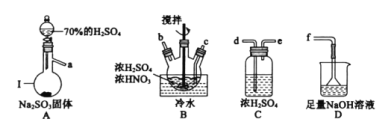
①仪器Ⅰ的名称为_________。
②按气流从左到右的顺序,上述仪器的连接顺序为____(填仪器接口字母,部分仪器可重复使用)。
③为了控制B中通入SO2的速率,可以采取的措施是_____。
④NOSO4H遇水分解的化学方程式为______,若去掉装置C会使NOSO4H的产量____(填“增大”、“减少”或“无影响”)。
(2)亚硝酰硫酸(NOSO4H)纯度的测定。
准确称取1.337g产品加入250mL碘量瓶中,加入60.00mL浓度为0.1000mol·L-1KMnO4标准溶液和10mL25%H2SO4溶液,然后摇匀。用0.2500mol·L-1Na2C2O4标准溶液滴定,消耗Na2C2O4溶液的体积20.00mL。
己知:ⅰ. ![]() + NOSO4H+
+ NOSO4H+ ![]() 、 +
、 + ![]() +
+ ![]() +
+ ![]()
ⅱ.![]()
①完成反应ⅰ的离子方程式:
____![]() +____
+____![]() ____
____![]() ____+____
____+____![]() +____
+____![]() +____
+____![]()
②滴定终点的现象为________。
③产品的纯度为_____%(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下的一密闭容器中事先放入1.56g过氧化钠,然后再通入乙烷与氧气的混合气体,用电火花引爆,直至反应完全为止,恢复到原温度,容器内压强近似为零。
(1)相同条件下,通入的气体氧气和乙烷的体积比是多少?_____
(2)通入氧气的质量最大应是多少?_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素W、X、Y、Z的原子序数依次增大且原子序数均不超过20,W、X同周期,W、Z的原子序数之和为28,它们组成的化合物![]() 是一种制造磷肥的原料。下列说法错误的是( )
是一种制造磷肥的原料。下列说法错误的是( )
A.非金属性:![]() B.
B.![]() 中不含共价键
中不含共价键
C.原子半径:![]() D.
D.![]() 分子中各原子最外层均达到8电子结构
分子中各原子最外层均达到8电子结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com