
【题目】下列根据实验操作及现象所得出的结论正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 测定等浓度的 | 前者pH比后者大 | 非金属性:S>C |
B | 将NaCl晶体分散在乙醇中,用激光笔照射 | 出现光亮的通路 | 该分散系为胶体 |
C | 向溶液中加入盐酸酸化的 | 产生白色沉淀 | 溶液中含有 |
D | 向填充有经硫酸处理的 | 固体由橙色变为绿色 | 乙醇具有氧化性 |
A.AB.BC.CD.D
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:X(g)+3Y(g)![]() 2Z(g),有关下列图像的说法错误的是
2Z(g),有关下列图像的说法错误的是
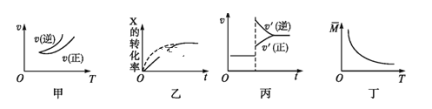
A.依据图甲可判断正反应为放热反应
B.在图乙中,虚线可表示使用了催化剂
C.若正反应的ΔH<0,图丙可表示升高温度使平衡向逆反应方向移动
D.由图丁中气体平均相对分子质量随温度的变化情况,可推知正反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖可发生如下转化:2CH3CH(OH)COOH(乳酸)![]() C6H12O6(葡萄糖)
C6H12O6(葡萄糖)![]() 2CH3CH2OH+2CO2↑,设NA为阿伏加德罗常数的值,下列说法正确的是( )
2CH3CH2OH+2CO2↑,设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,6.0g葡萄糖和乳酸混合物中氧原子数0.2NA
B.1mol葡萄糖中含有6.0NA个羟基
C.1mol乳酸与足量乙醇反应可生成NA个乳酸乙酯分子
D.相同条件下,相同物质的量的乳酸分别与足量的Na和NaHCO3溶液反应,产生气体的分子数均为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B、C、N、Mg、Al、Si均是重要短周期元素,其化合物在工业中有重要用途。请回答下列问题:
(1)硼氢化合物B2H6的结构如图所示,则B原子的杂化方式为___。2个硼原子与4个氢原子形成普通的σ键。这四个σ键在同一平面上,另外两个氢原子和这两个硼原子形成了两个垂直于该平面的“氢桥键”,该“氢桥键”为___中心___(原子)电子键(填阿拉伯数字)。
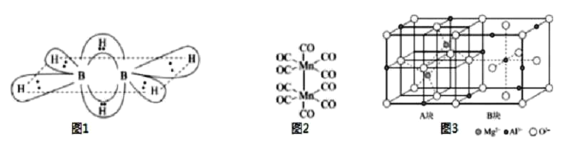
(2)CF4和PF3的沸点比较CF4___PF3(选填“>”或“<”)。PCl5中P原子采用sp3d杂化,形成三角双锥结构,而N原子只能形成NCl3,不能形成NCl5的原因是___。
(3)基态Mn原子核外特征电子排布式为___;已知CO的结构为C![]() O,Mn2(CO)10(结构如图2)中π键与配位键的个数比为___。
O,Mn2(CO)10(结构如图2)中π键与配位键的个数比为___。
(4)环状基型硅酸盐中硅氧四面体共角氧相连,并封闭成环,分单层环与双层环两大类,双层三环Si6O15,双层四环Si8O20、双层六环Si12O30、双层n环Si2nOm,当n=10时,m=___。
(5)尖晶石的结构如图3所示,请写出尖晶石的化学式___;A块、B块均为边长为apm的立方体,设阿伏伽德罗常数的值为NA,最近两个Al3+之间的距离为___pm,尖晶石的密度为___g/cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着新能源汽车产业的快速发展,带来大量的废旧电池,一种以废旧磷酸铁锂电池正极为原料回收铝、铁和锂元素的工艺流程如下:

已知:①![]() 易溶于硫酸中。
易溶于硫酸中。
②磷酸铁锂电池正极材料:磷酸铁锂![]() ,乙炔黑(主要成分碳单质,着火点大于750℃)导电剂和有机粘结剂PVDF(一种高分子有机物),均匀混合后涂覆于铝箔上。
,乙炔黑(主要成分碳单质,着火点大于750℃)导电剂和有机粘结剂PVDF(一种高分子有机物),均匀混合后涂覆于铝箔上。
回答下列问题:
(1)破碎的作用是________,烧结的主要目的是________。
(2)碱溶发生的非氧化还原反应的离子方程式是________________。
(3)若在实验室中进行操作1、2、3,需要用到的玻璃仪器有________。
(4)滤渣1酸浸的目的是________。
(5)滤渣2主要成分是________。
(6)pH与Fe、Li沉淀率关系如下表,为使滤液2中Fe、Li分离,溶液的pH应调节为________。
溶液pH与Fe、Li沉淀率关系
pH | 3.5 | 5 | 6.5 | 8 | 10 | 12 |
Fe沉淀率 | 66.5 | 79.2 | 88.5 | 97.2 | 97.4 | 98.1 |
Li沉淀率 | 0.9 | 1.3 | 1.9 | 2.4 | 4.5 | 8.0 |
(7)碳酸锂的溶解度随温度变化如下图所示。向滤液3中加入![]() ,将温度升至90℃是为了提高沉淀反应速率和________。
,将温度升至90℃是为了提高沉淀反应速率和________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.10molL-1醋酸溶液中滴加0.10molL-1NaOH溶液,滴加过程中测得pH与NaOH溶液体积(V)的关系如图所示。下列说法正确的是( )
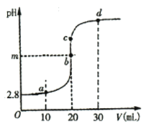
A.m=7
B.由水电离出的c(H+):a>b>c>d
C.由图可知,醋酸Ka的数量级为10-6
D.b与d之间的任意一点c都有:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学分析中,常常需要用KMnO4标准溶液,由于KMnO4晶体在室温下不太稳定,因而很难直接配制准确物质的量浓度的KMnO4溶液。用Na2C2O4固体测定KMnO4溶液浓度的实验步骤如下:(反应原理为:5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O)
步骤一:先粗配浓度约为0.15mol/L的KMnO4溶液500mL。
步骤二:准确称取Na2C2O4固体mg放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70~80℃,用步骤一所配KMnO4溶液进行滴定。记录相关数据。
步骤三:重复步骤二两到三次。计算得KMnO4溶液的物质的量浓度。
试回答下列问题:
(1)盛放KMnO4溶液的滴定管为___(填“酸式”或“碱式”)滴定管。
(2)该滴定实验滴定终点的现象是___。
(3)步骤二中滴定操作如图所示,正确的操作是___(填编号)。
A. B.
B. C.
C.
(4)若m的数值为1.340g,滴定的KMnO4溶液平均用量为25.00mL,则KMnO4溶液的浓度为___mol/L。
(5)若滴定完毕后读数时俯视,则实验误差会__(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧已成为夏季空气污染的元凶,地表产生臭氧的机理如图所示,NA代表阿伏加德罗常数的数值。下列说法正确的是( )

A.反应①、②、③都是氧化还原反应
B.16 O3和O2的混合气体,所含质子数为16NA
C.0.5mol NO2溶于水形成1L溶液,可得到0.5 molL1的硝酸溶液
D.标准状况下,11.2L的NO和O2混合气体所含的原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组实验操作、现象、解释或结论均正确的是( )。
操作 | 现象 | 解释或结论 | |
A | 将石蜡油蒸汽通过炽热的碎瓷片产生的气体通入溴的四氯化碳溶液 | 溴的四氯化碳溶液逐渐褪色 | 烷烃分解产生的烯烃与溴发生了氧化反应 |
B | 将螺旋状铜丝在酒精灯上灼烧至红热插入乙醇中 | 铜丝恢复光亮的紫红色且可闻到刺激性气味 | 铜丝做催化剂,乙醇被氧化成乙醛 |
C | 将乙醇、乙酸、浓硫酸混合共热产生的蒸汽通到饱和 | 液面上有透明的不溶于水的油状液体生成,并可以闻到香味 | 浓硫酸做催化剂、加热条件下,乙醇和乙酸发生了酯化反应 |
D | 蔗糖溶液加少许稀硫酸后水浴加热几分钟,然后取少量溶液加入新制 | 未见砖红色沉淀产生 | 蔗糖尚未水解 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com