
【题目】臭氧已成为夏季空气污染的元凶,地表产生臭氧的机理如图所示,NA代表阿伏加德罗常数的数值。下列说法正确的是( )

A.反应①、②、③都是氧化还原反应
B.16 O3和O2的混合气体,所含质子数为16NA
C.0.5mol NO2溶于水形成1L溶液,可得到0.5 molL1的硝酸溶液
D.标准状况下,11.2L的NO和O2混合气体所含的原子数为NA
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】如图所示测定溶液导电性实验的装置,甲与乙中盛有浓度相同的不同液体。接通电源后将甲中液体逐滴滴入乙中,发现灯泡由亮→暗灭→亮。下表中甲、乙所盛液体符合要求的是( )

选项 | 甲 | 乙 |
A | 氯化钠溶液 | 硝酸银溶液 |
B | 氨水 | 醋酸 |
C | 稀盐酸 | 碳酸钙悬浊液 |
D | 硫酸铜溶液 | 氢氧化钡溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作及现象所得出的结论正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 测定等浓度的 | 前者pH比后者大 | 非金属性:S>C |
B | 将NaCl晶体分散在乙醇中,用激光笔照射 | 出现光亮的通路 | 该分散系为胶体 |
C | 向溶液中加入盐酸酸化的 | 产生白色沉淀 | 溶液中含有 |
D | 向填充有经硫酸处理的 | 固体由橙色变为绿色 | 乙醇具有氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 用途广泛。某探究小组同学以废铜屑(含杂质铁)为原料,在实验室用如图所示装置制取硫酸铜,再进一步从所得溶液中获得无水硫酸铜。
用途广泛。某探究小组同学以废铜屑(含杂质铁)为原料,在实验室用如图所示装置制取硫酸铜,再进一步从所得溶液中获得无水硫酸铜。

Ⅰ.制备![]() 晶体
晶体
(1)仪器M名称为________。
(2)将反应温度控制在70℃-80℃,可采用的加热方法是________。
(3)从反应后的混合溶液中获得硫酸铜晶体的操作步骤如下:
①向溶液中加入________(填标号)至稀溶液pH约为4,过滤。
a. CuO b. NaOH溶液 c.![]()
②将滤液________、________(填操作名称)过滤、用乙醇洗涤、低温干燥,得![]() 晶体。
晶体。
(4)用乙醇代替蒸馏水洗涤晶体的目的是________,并缩短干燥所需时间。
Ⅱ.制备无水![]()
(5)灼烧法:实验室可在________(填仪器名称)中灼烧![]() ,晶体制备无水
,晶体制备无水![]() 。
。
(6)![]() 法:该方案采用如下图装置,________(填操作名称)A使
法:该方案采用如下图装置,________(填操作名称)A使![]() 气体进入装有
气体进入装有![]() 晶体的硬质玻璃管(已知:
晶体的硬质玻璃管(已知:![]() 的熔点为-105℃、沸点为76℃、遇水剧烈水解生成两种酸性气体)。装置B中
的熔点为-105℃、沸点为76℃、遇水剧烈水解生成两种酸性气体)。装置B中![]() 和
和![]() 发生反应的化学方程式为________。
发生反应的化学方程式为________。
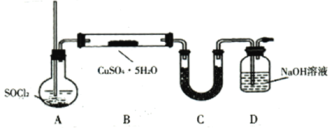
(7)![]() 法:相对灼烧法的优点为________________。(写出一点即可)
法:相对灼烧法的优点为________________。(写出一点即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组研究金属钾的性质。他们首先通过分析钾与钠的原子结构示意图及查阅有关资料,知道钾与钠属于同一类物质,在性质上有许多相似之处。但在金属活动性顺序表中,钾排在钠的前面,钾在空气中燃烧的产物是超氧化钾(KO2)。
(1)预测钾的化学性质,完成下列反应的化学方程式:
①钾在氯气中燃烧____________________________;
②点燃钾剧烈燃烧_____________________________;
③将小块钾投入冷水中______________________________;
(2)推测钾在自然界中的存在方式是(填“游离态”或“化合态”)________。
(3)该小组研究钾的性质时用到的主要方法有____________________________________。
(4)他们研究金属钾性质的程序是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有氯化钠和碘化钠的混合物共26.7 g,溶于水,通入足量氯气后,蒸干、灼烧,固体质量变为 17.55 g。
(1)原混合物中碘化钠的质量是________。
(2)原混合物中氯化钠的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列四种物质的溶液:①Na2CO3 ②Al2(SO4)3 ③CH3COOH ④NaHCO3。
(1)写出①溶液的电荷守恒:____________。
(2)常温下,0.1 mol·L-1④溶液的pH大于8,则溶液中c(H2CO3)_____c(CO32-)(填“>”、“=”或“<”),原因是_______(用离子方程式和必要的文字说明)。
(3)常温下0.1 mol/L的③溶液加水稀释过程中,下列表达式的数据一定变大的是_________。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(4)用②和④的溶液可以制作泡沫灭火剂,其原理为:________________(用离子方程式解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种短周期元素A、B、C、D,它们的核电荷数依次增大。A与C,B与D分别是同主族元素。B、D质子数之和是A、C质子数之和的2倍。这四种元素中A、C、D的单质均可在B的单质中燃烧。
(1)A的元素名称是________,C的元素符号是________。
(2)D元素位于元素周期表的第______周期第______族。
(3)C元素的单质在B的单质中燃烧的产物的化学式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(如图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,已知0-t1时,原电池的负极是Al片,反应过程中有红棕色气体产生。下列说法不正确的是

A. 0-t1时,正极的电极反应式为:2H++ NO3- - e-=NO2+ H2O
B. 0-t1时,溶液中的H+ 向Cu电极移动
C. t1时,负极的电极反应式为:Cu–2e-= Cu2+
D. t1时,原电池中电子流动方向发生改变是因为Al在浓硝酸中钝化,氧化膜阻碍了Al的进一步反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com