
【题目】现有以下物质:①NaCl固体;②液态CO2;③液态氯化氢;④汞;⑤固体BaSO4;⑥蔗糖;⑦酒精;⑧熔融的Na2CO3,请回答下列问题:
(1)以上物质中能导电的是________;
(2)以上物质属于电解质的是________;
(3)以上物质属于非电解质的是_______;
(4)以上物质溶于水后形成的溶液能导电的是______;
(5)属于盐的有________;
(6)写出⑧溶于水中的电离方程式_____;
(7)分离胶体和溶液常用的方法叫__________;
(8)等质量的O2和O3所含原子个数比为______;
(9)设NA为阿伏加德罗常数的数值,若ag某气体中含有的分子数为b,则c g该气体在标准状况下的体积是___________。(用含有NA的式子表示)
【答案】④⑧ ①③⑤⑧ ②⑥⑦ ①②③⑧ ①⑤⑧ Na2CO3=2Na++CO32- 渗析 1:1 ![]() L
L
【解析】
电解质:在水溶液中或熔融状态下能导电的化合物;
非电解质:在水溶液中和熔融状态下不能导电的化合物;
物质导电条件:存在自由移动的离子,或者存在自由移动的电子;
金属离子或铵根离子(NH4+)与酸根离子结合的化合物属于盐;
碳酸钠为强电解质,在水溶液中完全电离产生钠离子和碳酸根离子;
根据胶体与溶液中分散质微粒大小分离;
利用n=![]() 及N=n·NA计算O原子数目;
及N=n·NA计算O原子数目;
利用微粒数目与质量成正比计算cg该气体的分子数目,再结合N=n·NA计算气体的物质的量,最后根据V=n·Vm计算气体在标准状况下的体积。
①NaCl固体,属于电解质;不含自由移动的离子,因此不导电;溶于水,能产生自由移动的离子,水溶液能导电;
②液态CO2,属于非电解质;不含自由移动的离子,因此不导电;溶于水,与水反应生成电解质H2CO3,能产生自由移动的离子,水溶液能导电;
③液态氯化氢,属于电解质;由分子构成,不含自由移动的离子,因而不导电;溶于水,在水分子作用下电离产生自由移动的离子,水溶液能导电;
④汞是金属单质,既不是电解质也不是非电解质;含有自由移动的电子,能导电;不溶于水;
⑤固体BaSO4,是由金属阳离子Ba2+和酸根离子SO42-组成的化合物,属于电解质;不含自由移动的离子,因而不导电;水中溶解度很小,水溶液几乎不导电;
⑥蔗糖,非电解质;不含自由移动的离子,不导电,水溶液也不导电;
⑦酒精,非电解质;不含自由移动的离子,不导电,水溶液也不导电;
⑧熔融的Na2CO3,是电解质;含有自由移动的离子,能导电;水溶液能电离产生自由移动的离子Na+、CO32-,能导电;
因此在上述物质中
(1)能导电的是④⑧;
(2)属于电解质的是①③⑤⑧;
(3)属于非电解质的是②⑥⑦;
(4)物质溶于水后形成的溶液能导电的是①②③⑧;
(5)①NaCl固体;⑤固体BaSO4;⑧熔融的Na2CO3,都是由金属阳离子与酸根离子形成化合物,属于盐,故物质序号应该是①⑤⑧;
(6)碳酸钠为强电解质,在水溶液中完全电离产生Na+和CO32-,电离方程式:Na2CO3=2Na++CO32-;
(7)胶体分散质微粒直径在1nm~100nm之间,不能透过半透膜,而溶液中溶质微粒直径小于1nm,可以透过半透膜,因此可用半透膜,通过渗析的方法分离胶体和溶液;
(8)假设物质的质量都是mg,则O2中含有的O原子的物质的量是n(O)=![]() =
=![]() mol,O3中含有的O原子的物质的量是n(O)=
mol,O3中含有的O原子的物质的量是n(O)=![]() =
=![]() mol,可见等质量的O2和O3中含有的O原子的物质的量相同,根据N=n·NA可知:原子的物质的量相等,则原子数目也相等,故二者含有的O原子个数比为1:1;
mol,可见等质量的O2和O3中含有的O原子的物质的量相同,根据N=n·NA可知:原子的物质的量相等,则原子数目也相等,故二者含有的O原子个数比为1:1;
(9)若ag某气体中含有的分子数为b,则c g该气体含有的分子数目为N=![]() ,由于NA为阿伏加德罗常数的数值,则cg该气体的物质的量是n=
,由于NA为阿伏加德罗常数的数值,则cg该气体的物质的量是n= =
=![]() mol,则该气体在标准状况下的体积V=n·Vm=
mol,则该气体在标准状况下的体积V=n·Vm=![]() mol×22.4L/mol=
mol×22.4L/mol=![]() L。
L。


科目:高中化学 来源: 题型:
【题目】碘化钠在医疗及食品方面有重要的作用。实验室用NaOH、单质碘和水合肼(N2H·H2O)为原料制备碘化钠。已知:水合肼具有还原性。回答下列问题:
(1)水合肼的制备有关反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH![]() N2H4·H2O+NaCl+Na2CO3
N2H4·H2O+NaCl+Na2CO3
①制取次氯酸钠和氧氧化钠混合液的连接顺序为__________(按气流方向,用小写字母表示)。
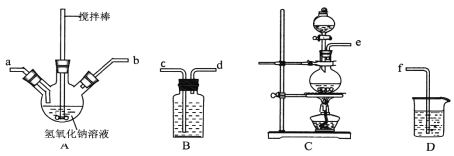
若该实验温度控制不当,反应后测得三颈瓶内ClO-与ClO3-的物质的量之比为5:1,则氯气与氢氧化钠反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为________。
②制备水合肼时,应将___________滴到 __________ 中(填“NaClO溶液”或“尿素溶液”),且滴加速度不能过快。
(2)碘化钠的制备采用水合肼还原法制取碘化钠固体,其制备流程如图所示:
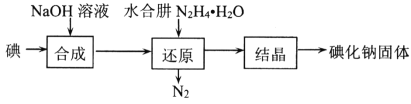
在“还原”过程中,主要消耗反应过程中生成的副产物IO3-,该过程的离子方程式为______________________________________。工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是_________________________________。
(3)测定产品中NaI含量的实验步骤如下:
a.称取10.00g样品并溶解,在500mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入M溶液作指示剂:
c.用0.2100mol·L-1的Na2S2O3标准溶液滴定至终点(反应方程式为;2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准溶液的体积为15.00mL。
①M为____________(写名称)。
②该样品中NaI的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列有关叙述正确的是( )
A.1 mol CH4(g)和2 mol O2(g)的能量总和小于1 mol CO2(g)和2 mol H2O(g)的能量总和
B.标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数小于2NA
C.1 mol Fe在氧气中充分燃烧失去3NA个电子
D.在标准状况下,NA个CHCl3分子所占的体积约为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达到平衡,平衡常数K=![]() 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A. 该反应的焓变为负值
B. 缩小容器体积,平衡不移动,H2浓度一定增大
C. 升高温度,正反应速率增大,逆反应速率减小
D. 该反应化学方程式为CO+H2OCO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下平衡:2SO2(g)+O2(g)2SO3(g) △H= QkJ/mol(Q>0),某研究小组研究了其他条件不变时,改变某一条件对上述平衡的影响,下列分析正确的是

A. 图I研究的是t0时刻增大O2的浓度对平衡的影响
B. 图II研究的是t0时刻加入催化剂后对反应速率和平衡的影响
C. 图III研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图III研究的是温度对化学平衡的影响,且乙的温度较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是( )
A.某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有![]()
B.某溶液中加![]() 溶液生成白色沉淀,说明原溶液中有
溶液生成白色沉淀,说明原溶液中有![]()
C.某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有![]()
D.某溶液中加稀硫酸溶液生成无色无味气体,说明原溶液中有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。 合成塔中发生反应为: N2(g)+3H2(g)![]() 2NH3(g) △H<0
2NH3(g) △H<0
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H>0
CO2(g)+H2(g) △H>0
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。
该温度下此反应的平衡常数K =__________________________。
②保持温度不变,向上述平衡体系中再加入0.1mol CO,当反应重新建立平衡时,水蒸气的总转化率α (H2O)__________。
(2)下表为不同温度下合成氨反应的平衡常数。由表可推知T1_____573K(填“>”、“<”或“=”)。
T/K | T1 | 573 | T2 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
(3)673K,30MPa下n(NH3) 和n(H2) 随时间变化的关系如下图所示依据上图,下列有关叙述正确的是(填写序号)_________________。

A.c点表示n(NH3)和n (H2)相等
B.c点表示NH3生成速率与NH3分解速率相同
C.e点和d点时反应的平衡常数相同
D.c点时正反应速率大于逆反应速率
(4)用NO2溶于水制硝酸:3NO2+H2O![]() 2HNO3+NO。从生产流程看,吸收塔中需
2HNO3+NO。从生产流程看,吸收塔中需
要补充空气,其原因用化学平衡移动的理论进行解释是______________。
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索
利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮气可以作食品包装、灯泡等的填充气,也是合成纤维、合成橡胶的重要原料。实验室制备氮气的反应式:NH4Cl+NaNO2![]() NaCl+N2↑+2H2O。下列说法正确的是( )
NaCl+N2↑+2H2O。下列说法正确的是( )
A.元素的电负性:N>O>H
B.氮气分子的电子式:![]()
C.钠电离最外层一个电子所需要的能量:①>② ![]()
D.水中的氢键可以表示为:O—H…O,其中H…O之间的距离即为该氢键的键长
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)6.4gM和17.0gN恰好完全反应,生成0.4molX和12.2gY,则X的摩尔质量为:___。
(2)实验室需要制备22.4L(标准状况)H2,现用质量分数为90.0%的锌粒与足量的稀盐酸反应(假设杂质不与稀盐酸反应),问:(要求写出计算过程)
①至少需要质量分数为90.0%的锌粒多少克?___
②生成的氯化锌的物质的量是多少?___
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com