
【题目】咖啡酸乙酯具有抗炎作用且有治疗自身免疫性疾病的潜力,其合成路线如图所示:
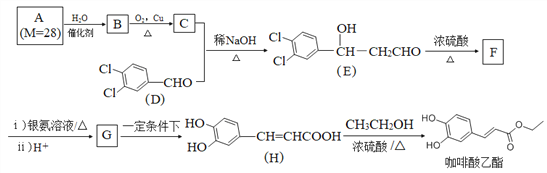
回答下列问题:
(1)C+D→E反应类型为______。F中含氧官能团的名称是______。
(2)D分子中位于同一平面上的原子最多有______个。G的结构简式为______。
(3)H→咖啡酸乙酯的化学方程式为______。
(4)芳香族化合物M是H的同分异构体,1 molM与足量碳酸氢钠溶液反应生成2 molCO2,M的结构有______种;其中核磁共振氢谱为5组峰,峰面积比为1∶2∶2∶2∶1的结构简式为______。
(5)以上图中的C和甲醛为原料,设计合成C5H12O4(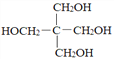 )的路线(无机试剂任任选)。________________________
)的路线(无机试剂任任选)。________________________
【答案】 加成反应 醛基 14 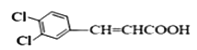
 10
10 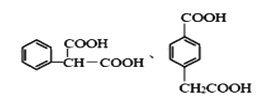
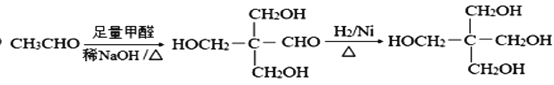
【解析】A的相对分子质量是28,A是乙烯,与水加成生成B是乙醇,催化氧化生成C是乙醛。C与D发生醛基的加成反应生成E,E在浓硫酸的作用下发生消去反应生成F为![]() ,F发生银镜反应并酸化后生成G为
,F发生银镜反应并酸化后生成G为![]() 。G发生水解反应生成H,H与乙醇发生取代反应生成咖啡酸乙酯。(1)根据以上分析可知C+D→E反应类型为加成反应。F中含氧官能团的名称是醛基。(2)醛基和苯环均是平面形结构,则D分子中位于同一平面上的原子最多有14个。G的结构简式为
。G发生水解反应生成H,H与乙醇发生取代反应生成咖啡酸乙酯。(1)根据以上分析可知C+D→E反应类型为加成反应。F中含氧官能团的名称是醛基。(2)醛基和苯环均是平面形结构,则D分子中位于同一平面上的原子最多有14个。G的结构简式为![]() 。(3)H→咖啡酸乙酯的化学方程式为
。(3)H→咖啡酸乙酯的化学方程式为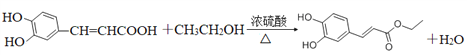 。(4)芳香族化合物M是H的同分异构体,1molM与足量碳酸氢钠溶液反应生成2 mol CO2,说明含有2个羧基,如果苯环上有3个取代基,应该是2个羧基和1个甲基,如果是两个取代基,应该是-COOH和-CH2COOH,如果是一个取代基,应该是-CH(COOH)2,M的结构有10种;其中核磁共振氢谱为5组峰,峰面积比为1∶2∶2∶2∶1的结构简式为
。(4)芳香族化合物M是H的同分异构体,1molM与足量碳酸氢钠溶液反应生成2 mol CO2,说明含有2个羧基,如果苯环上有3个取代基,应该是2个羧基和1个甲基,如果是两个取代基,应该是-COOH和-CH2COOH,如果是一个取代基,应该是-CH(COOH)2,M的结构有10种;其中核磁共振氢谱为5组峰,峰面积比为1∶2∶2∶2∶1的结构简式为![]() 、
、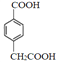 。(5)根据已知信息结合逆推法可知以甲醛、C为原料合成C5H12O4的路线为
。(5)根据已知信息结合逆推法可知以甲醛、C为原料合成C5H12O4的路线为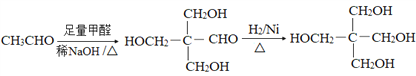 。
。


科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是重要的有机化工原料,可用于制取氢气、甲酸甲酯(HCOOCH3)。(1) 在一定条件下用氧气催化氧化甲醇制氢气,原料气中n(O2)/n(CH3OH)对反应的选择性影响如图所示(选择性越大表示生成的该物质越多)。当n(O2)/n(CH3OH)=0.25 时,主要反应的化学方程式为____________,制备H2 时最好控制n(O2)/n(CH3OH)=___________。

(2)甲醇催化脱氢制甲酸甲酯的反应为:2CH3OH(g)![]() HCOOCH3(g)+2H2(g) △H =a kJ·mol-1
HCOOCH3(g)+2H2(g) △H =a kJ·mol-1
①已知 :CO(g)+ l/2O2(g)=CO2(g) △H1 =-283kJ·mol-1
2CH3OH(g)+O2(g)=2CO2(g)+4 H2(g) △H2 =-386kJ·mol-1
2CO(g)+2 H2(g)=HCOOCH3(g ) △H3 =-134kJ·mol-1
a=_________________。
②在310℃下,将2mol 甲醇置于VL恒容密闭容器中,反应20 分钟后到达平衡,平衡时甲醇和氢气的分压相等。从开始到平衡时甲醇的平均反应速率为____ mol·L-1·min-1,若平衡时气体总压为P总=5×104Pa,Kp=_______。(已知: Kp是用平衡气体分压代替平衡浓度求得的平衡常数。气体分压=气体总压×气体的物质的量分数)。若在310℃下,将2mol 甲醇置于VL恒压密闭容器中,反应到达平衡时甲醇的分压______氢气的分压(填“>”,“=”或“<”)。
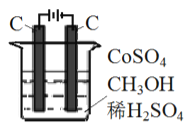
(3) 电解法可消除甲醇对水质造成的污染,原理是: 通电将Co2+ 氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如图所示装置模拟上述过程,请写出:
①阴极的电极反应式_______________________________________。
②除去甲醇的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。相关电解槽装置如图所示,用Cu-Si合金作硅源,在950℃利用三层液熔盐进行电解精炼,有关说法不正确的是
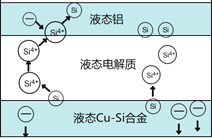
A. 在该液相熔体中Cu优先于Si被氧化,Si4+优先于Cu2+被还原
B. 电子由液态Cu-Si合金流出,从液态铝流入
C. 三层液熔盐的作用是增大电解反应面积,提高硅沉积效率
D. 电流强度不同,会影响硅提纯速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑下列说法正确的是( )
A. KNO3是还原剂,其中氮元素被氧化
B. 生成物中的N2是氧化产物,K2O是还原产物
C. 每转移1 mol电子,可生成N2的体积为35.84 L
D. 若有65 g NaN3参加反应,则被氧化的N的物质的量为3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的化合物在科研、生活及化学工业中具有重要的作用。
(1)在废水处理领域中,H2S或Na2S能使某些金属离子生成极难溶的硫化物而除去。25 ℃,在0.10 mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如下表(忽略溶液体积的变化、H2S的挥发)。
pH | 3 | 5 | 7 | 9 | 11 |
c(S2-)/ (mol·L-1) | 1.4×10-15 | 1.4×10-11 | 6.8×10-8 | 1.3×10-5 | 1.3×10-3 |
某溶液含0.020 mol·L-1 Mn2+、0.10 mol·L-1 H2S,当溶液的pH=5时,Mn2+开始沉淀,MnS的溶度积为______。
(2)工业上采用高温分解H2S制取氢气,其反应为2H2S(g)![]() 2H2(g)+S2(g) ΔH1,在膜反应器中分离出H2。
2H2(g)+S2(g) ΔH1,在膜反应器中分离出H2。
①已知:H2S(g)![]() H2(g)+S(g) ΔH2;2S(g)
H2(g)+S(g) ΔH2;2S(g)![]() S2(g) ΔH3,则ΔH1=______ (用含ΔH2、ΔH3的式子表示)。
S2(g) ΔH3,则ΔH1=______ (用含ΔH2、ΔH3的式子表示)。
②在密闭容器中,充入0.10 mol H2S(g),发生反应2H2S(g)![]() 2H2(g)+S2(g),控制不同的温度和压强进行实验,结果如图所示。
2H2(g)+S2(g),控制不同的温度和压强进行实验,结果如图所示。
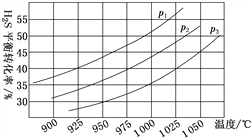
图中压强p1、p2、p3由大到小的顺序为______,理由是______。若容器的容积为2.0 L,则压强为p3,温度为950 ℃时,反应经3 h达到平衡,化学反应速率v(S2)=______;若压强p2=7.2 MPa、温度为975 ℃时,该反应的平衡常数Kp=______(用平衡分压代替平衡浓度,分压=总压×物质的量分数,计算结果保留两位有效数字)。若保持压强不变,升温至1000 ℃时,则该反应的平衡常数_____(填“增大”“不变”或“减小”)。
(3)工业上用惰性电极电解KHSO4饱和溶液制取H2O2,示意图如图所示:
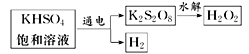
①低温电解KHSO4饱和溶液时阳极的电极反应式为______。
②K2S2O8水解时生成H2O2和KHSO4,该反应的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】英国曼彻斯特大学科学家安德烈·海姆和康斯坦丁·诺沃肖洛夫。共同工作多年的二人因“突破性地”用撕裂的方法从石墨中成功获得超薄材料石墨烯而获奖。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型示意图如图:
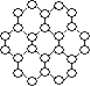
(1)下列有关石墨烯说法正确的是______。
a.12 g石墨烯含![]() 键数为NA
键数为NA
b.石墨烯分子中所有原子可以处于同一平面
c.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
d.石墨烯中每个C原子连接3个六元环,每个六元环占有6个C原子
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①基态铜原子能量最高的电子占据的能级符号是_____;第四周期元素中,最外层电子数与铜相同的元素还有______。
②下列分子属于非极性分子的是______。
a.甲烷 b.二氯甲烷 c.苯 d.乙醇
③乙醇的沸点要高于相对分子质量比它还高的丁烷,请解释原因______。
④酞菁与酞菁铜染料分子结构如下图1,酞菁分子中碳原子采用的杂化方式是______。

⑤金与铜可形成的金属互化物合金(如上图2),它的化学式可表示为______;在Au周围最近并距离相等的Cu有______个,若2个Cu原子核的最小距离为d pm,该晶体的密度可以表示为______g/cm3。(阿伏加德罗常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的碘元素。如图是实验室从海藻里提取碘的流程的一部分。下列判断正确的是
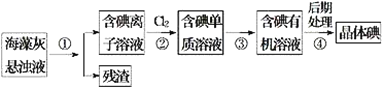
A. 步骤④的操作是过滤
B. 可用淀粉溶液检验步骤②的反应是否进行完全
C. 步骤①、③的操作分别是过滤、萃取
D. 步骤③中加入的有机溶剂可能是酒精或四氯化碳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com