
【题目】硫的化合物在科研、生活及化学工业中具有重要的作用。
(1)在废水处理领域中,H2S或Na2S能使某些金属离子生成极难溶的硫化物而除去。25 ℃,在0.10 mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如下表(忽略溶液体积的变化、H2S的挥发)。
pH | 3 | 5 | 7 | 9 | 11 |
c(S2-)/ (mol·L-1) | 1.4×10-15 | 1.4×10-11 | 6.8×10-8 | 1.3×10-5 | 1.3×10-3 |
某溶液含0.020 mol·L-1 Mn2+、0.10 mol·L-1 H2S,当溶液的pH=5时,Mn2+开始沉淀,MnS的溶度积为______。
(2)工业上采用高温分解H2S制取氢气,其反应为2H2S(g)![]() 2H2(g)+S2(g) ΔH1,在膜反应器中分离出H2。
2H2(g)+S2(g) ΔH1,在膜反应器中分离出H2。
①已知:H2S(g)![]() H2(g)+S(g) ΔH2;2S(g)
H2(g)+S(g) ΔH2;2S(g)![]() S2(g) ΔH3,则ΔH1=______ (用含ΔH2、ΔH3的式子表示)。
S2(g) ΔH3,则ΔH1=______ (用含ΔH2、ΔH3的式子表示)。
②在密闭容器中,充入0.10 mol H2S(g),发生反应2H2S(g)![]() 2H2(g)+S2(g),控制不同的温度和压强进行实验,结果如图所示。
2H2(g)+S2(g),控制不同的温度和压强进行实验,结果如图所示。
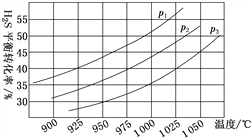
图中压强p1、p2、p3由大到小的顺序为______,理由是______。若容器的容积为2.0 L,则压强为p3,温度为950 ℃时,反应经3 h达到平衡,化学反应速率v(S2)=______;若压强p2=7.2 MPa、温度为975 ℃时,该反应的平衡常数Kp=______(用平衡分压代替平衡浓度,分压=总压×物质的量分数,计算结果保留两位有效数字)。若保持压强不变,升温至1000 ℃时,则该反应的平衡常数_____(填“增大”“不变”或“减小”)。
(3)工业上用惰性电极电解KHSO4饱和溶液制取H2O2,示意图如图所示:
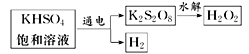
①低温电解KHSO4饱和溶液时阳极的电极反应式为______。
②K2S2O8水解时生成H2O2和KHSO4,该反应的化学方程式______。
【答案】 2.8×10-13 2ΔH2+ΔH3 p3>p2>p1 该反应的正反应为气体分子数增加的反应,其他条件相同时,压强增大平衡逆向移动,H2S的转化率减小,故p3>p2>p1 0.0025 mol·L-1·h-1 0.53 增大 2SO![]() -2e-===S2O
-2e-===S2O![]() K2S2O8+2H2O===H2O2+2KHSO4
K2S2O8+2H2O===H2O2+2KHSO4
【解析】试题分析:(1)某溶液含0.020 molL-1Mn2+、0.1 molL-1H2S,当溶液的pH=5时,溶液里c(S2-)=1.4×10-11molL-1,Mn2+开始沉淀,则MnS的溶度积= c(S2-)×c(Mn2+)=0.020×1.4×10-11=2.8×10-13; (2)工业上采用高温分解H2S制取氢气,其反应为2H2S(g)![]() 2H2(g)+S2(g) △H1,在膜反应器中分离出H2。①ⅰH2S(g)
2H2(g)+S2(g) △H1,在膜反应器中分离出H2。①ⅰH2S(g)![]() H2(g)+S(g) △H2,ⅱ2S(g)
H2(g)+S(g) △H2,ⅱ2S(g)![]() S2(g)△H3,根据盖斯定律可知2H2S(g)
S2(g)△H3,根据盖斯定律可知2H2S(g)![]() 2H2(g)+S2(g)为ⅰ×2+ⅱ得到的,故△H1=2ΔH2+ ΔH3;②因为恒温下压强越大,H2S的转化率越低,则图中压强p1、p2、p3由大到小的顺序为p3>p2>p1,理由是该反应的正反应为气体分子数增加的反应,其他条件相同时,压强增大平衡逆向移动,H2S 的转化率减小,故p3>p2>p1。压强为p3,温度为950℃时,H2S的转化率为30%,即变化量为0.10mol×30%=0.03mol,生成的S2(g)为0.03mol/2=0.015mol,达到平衡时v(S2)="(" 0.015mol/2L)÷3h=0.0025mol/(L·h);若压强p2=7.2MPa,温度为975℃时,H2S的转化率为40%,即变化量为0.10mol×40%=0.04mol,则平衡时H2(g)为0.04mol,S2(g)的物质的量为0.02mol,H2S(g)的物质的量为0.06mol,总的物质的量为0.12mol,H2S(g)、H2(g)、S2(g)的分压分别为7.2MPa×(0.06/0.12)=3.6MPa,7.2MPa×(0.04/0.12)=2.4MPa,7.2MPa×(0.02/0.12)=1.2MPa,则反应的平衡常数Kp=(2.4MPa)2×1.2MPa÷(3.6MPa)2=0.53MPa,因恒压条件下,温度越高,H2S的转化率越大,说明升高温度平衡正向移动,若保持压强不变,升温到1000℃时,则该反应的平衡常数增大;(3)①低温电解饱和KHSO4溶液时阳极的电极反应式为2SO4 22e=S2O82;②K2S2O8水解时生成H2O2和KHSO4,该反应的化学方程式为K2S2O8+ 2H2O = H2O2+2KHSO4。
2H2(g)+S2(g)为ⅰ×2+ⅱ得到的,故△H1=2ΔH2+ ΔH3;②因为恒温下压强越大,H2S的转化率越低,则图中压强p1、p2、p3由大到小的顺序为p3>p2>p1,理由是该反应的正反应为气体分子数增加的反应,其他条件相同时,压强增大平衡逆向移动,H2S 的转化率减小,故p3>p2>p1。压强为p3,温度为950℃时,H2S的转化率为30%,即变化量为0.10mol×30%=0.03mol,生成的S2(g)为0.03mol/2=0.015mol,达到平衡时v(S2)="(" 0.015mol/2L)÷3h=0.0025mol/(L·h);若压强p2=7.2MPa,温度为975℃时,H2S的转化率为40%,即变化量为0.10mol×40%=0.04mol,则平衡时H2(g)为0.04mol,S2(g)的物质的量为0.02mol,H2S(g)的物质的量为0.06mol,总的物质的量为0.12mol,H2S(g)、H2(g)、S2(g)的分压分别为7.2MPa×(0.06/0.12)=3.6MPa,7.2MPa×(0.04/0.12)=2.4MPa,7.2MPa×(0.02/0.12)=1.2MPa,则反应的平衡常数Kp=(2.4MPa)2×1.2MPa÷(3.6MPa)2=0.53MPa,因恒压条件下,温度越高,H2S的转化率越大,说明升高温度平衡正向移动,若保持压强不变,升温到1000℃时,则该反应的平衡常数增大;(3)①低温电解饱和KHSO4溶液时阳极的电极反应式为2SO4 22e=S2O82;②K2S2O8水解时生成H2O2和KHSO4,该反应的化学方程式为K2S2O8+ 2H2O = H2O2+2KHSO4。


 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】SO2是主要大气污染物之一,工业上可用如图装置吸收转化SO2(A、B 为惰性电极)。下列说法错误的是( )

A. a为电源的正极
B. B 极上发生氧化反应
C. 离子交换膜为阳离子交换膜
D. A极区溶液的pH逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N 是一种重要的元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)基态N 原子的核外电子排布式是_____________;最高能级的电子云轮廓图形状为_____________;N原子的第一电离能比O原子的大,其原因是_________________________。
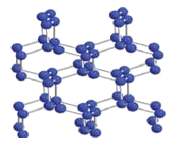
(2)在高压下氮气会发生聚合得到高聚氮,晶体结构如图所示。晶体中每个氮原子与另外三个氮原子结合形成空间网状结构。氮原子的杂化轨道类型为_________。这种高聚氮N-N 键的键能为160kJ/mol,而N2 的键能为942kJ/mol,其可能潜在的应用是______________________。
(3)南京理工大学团队成功合成了能在室温稳定存在的五氮阴离子盐(N5)6(H3O)3(NH4)4Cl,经X射线衍射测得晶体结构,其局部结构如图所示(其中N5-的立体结构是平面五元环)。下列说法正确的是________。
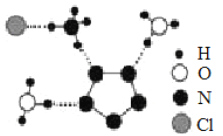
A.所有N 原子的价电子层均有孤对电子 B.两种阳离子均含有配位键
C.两种阳离子不是等电子体 D.阴阳离子之间只存在离子键
(4)NH3 与F2 反应生成NF3 和NH4F,这四种物质中,沸点由高到低的顺序是______;NF3中氮元素显_______价;属极性分子的有_________________。
(5)立方氮化硼称为超硬材料。晶胞结构如图所示:
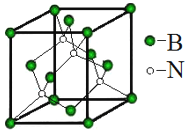
硼原子的配位数是__________。若晶胞参数为anm,则晶体的密度为____g·cm3 (用NA 表示阿伏伽德罗常数的值,列出代数式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋及其化合物在工业生产中用途广泛,某研究小组用浮选过的辉铋矿(主要成分是Bi2S3,还含少量SiO2等杂质)制备NaBiO3,其流程如下:
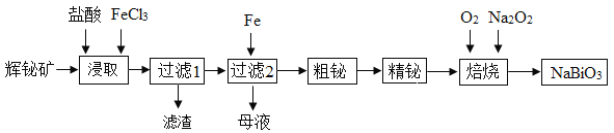
已知:水解能力:Bi3+>Fe3+。
回答下列问题:
(1)“浸取”时,为了提高浸取速率,可采取的措施有______(任写一条);过滤1的滤渣的主要成分有______(填化学式)。
(2)浸取时加入过量浓盐酸的目的是______;“母液”中通入气体X后可循环利用,气体X为______(填名称)。
(3)写出焙烧时生成铋酸钠的化学方程式______;当消耗标准状况下4.48 L O2时,转移电子的数目是______。
(4)25℃时,向浓度均为0.04 mol·L-1的Cu2+、Pb2+、Bi3+的混合溶液中滴加(NH4)2S溶液(设溶液体积增加1倍),当c(Pb2+)=10-5 mol·L-1时恰好完全沉淀,所得溶液中c(Cu2+)∶c(Bi3+)=______。[已知:Ksp(CuS)=6.0×10-36、Ksp(PbS)=3.0×10-28、Ksp(Bi2S3)=1.6×10-20]
(5)用双硫腙(H2Dz,二元弱酸)~CC14络合萃取法可从工业废水中提取金属离子:H2Dz先将金属离子络合成电中性的物质[如Cu(HDz)2等],再用CCl4萃取此络合物。下图是用上述方法处理含有Hg2+、Bi3+、Zn2+的废水时的酸度曲线(E%表示金属离子以络合物形式被萃取分离的百分率)。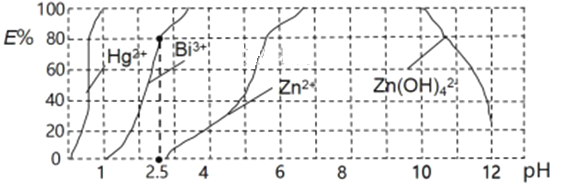
①当调节pH=2.5时,铋(Bi)的存在形式有______。
②向萃取后的CCl4中加入NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸乙酯具有抗炎作用且有治疗自身免疫性疾病的潜力,其合成路线如图所示:
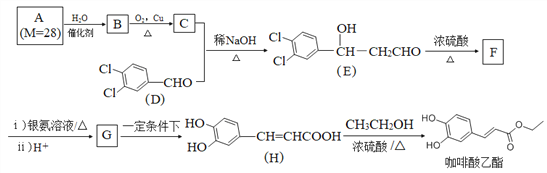
回答下列问题:
(1)C+D→E反应类型为______。F中含氧官能团的名称是______。
(2)D分子中位于同一平面上的原子最多有______个。G的结构简式为______。
(3)H→咖啡酸乙酯的化学方程式为______。
(4)芳香族化合物M是H的同分异构体,1 molM与足量碳酸氢钠溶液反应生成2 molCO2,M的结构有______种;其中核磁共振氢谱为5组峰,峰面积比为1∶2∶2∶2∶1的结构简式为______。
(5)以上图中的C和甲醛为原料,设计合成C5H12O4(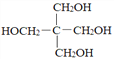 )的路线(无机试剂任任选)。________________________
)的路线(无机试剂任任选)。________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是最常见的二次电池,其构造示意图如下。发生反应的化学方程式为:
Pb(s) + PbO2(s) + 2H2SO4(aq) ![]() 2PbSO4(s) + 2H2O(l)
2PbSO4(s) + 2H2O(l)
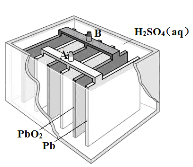
下列说法不正确的是
A.放电时,正极反应为:PbO2(s) + 4H+(aq) + SO42-(aq) +2e- = PbSO4(s) + 2H2O(l)
B.充电时,应将外接直流电源的正极与铅蓄电池的接线柱A相接
C.实验室用铅蓄电池做电源精炼粗铜时,应将粗铜与接线柱B相连接
D.铅蓄电池做电源电解Na2SO4溶液时,当有2 mol O2产生时,消耗8 mol H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂或分离方法不正确的是
选项 | 提纯的物质 | 除杂试剂 | 分离方法 |
A | 乙炔(硫化氢) | 硫酸铜溶液 | 洗气 |
B | 苯(苯酚) | 浓溴水 | 过滤 |
C | 乙醇(乙酸) | 生石灰 | 蒸馏 |
D | 苯甲酸(可溶性杂质) | 水 | 重结晶 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol/L CH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中c(CH3COO-)/[c(CH3COOH).c(OH-)]增大
C. 向盐酸中加入氨水至中性,溶液中[c(NH4+)/c(Cl-)]>1
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中c(Cl-)/c(Br-)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】福酚美克是一种影响机体免疫力功能的药物,可通过以下方法合成:
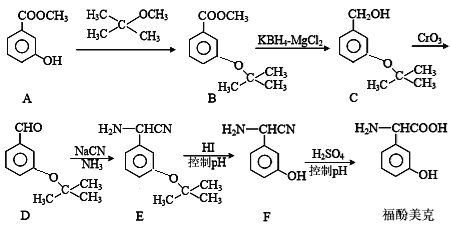
(1)物质A的名称是__________________________
(2)B→C的转化属于_______反应(填反应类型)。
(3)上述流程中设计A→B步骤的目的是_________________________________。
(4)A与足量氢氧化钠溶液反应的方程式为:_________________________________。
(5)A的同分异构体X满足下列条件:
Ⅰ.能与NaHCO3反应放出气体; Ⅱ.能与FeCl3溶液发生显色反应。
符合上述条件的同分异构体有______种。其中核磁共振氢谱有5组吸收峰的结构简式为_____________。
(6)参照上述合成路线和信息,以乙醛为原料(无机试剂任选),设计制
的合成路线:____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com