
����Ŀ��Ǧ��������緢�ֺ�ʹ�õ�һ���ؽ�������ҵ����Ǧ����(��Ҫ�ɷֺ�PbS)Ϊԭ�ϣ��ֻ�ʪ�����ַ���ұ����
��ұ����Ǧ���������£�

(1)����¯����Ҫ��Ӧ�Ļ�ѧ����ʽΪ______________________��
(2)�ķ�¯�н�̿��������___________���������з�Ӧ�����ӷ���ʽΪ___________��
��ʪ����Ǧ�Ĺ����������£�

��֪���ٲ�ͬ�¶���PbCl2���ܽ�����±���ʾ��

��PbCl2Ϊ������ˮ��������ʣ��ں�Cl������Һ�д���ƽ�⣺
PbCl2(aq)+2Cl��(aq)![]() PbCl42��(aq)��
PbCl42��(aq)��
(3)��ȡ�����з�����Ӧ�����ӷ���ʽΪ______________________��
(4)����aΪ������ˮϡ�Ͳ���ȴ���ò�����������Һ1��PbCl2��������������Ľ���Ϊ___________��
(5)����Һ3����Һ2�ֱ�������ͼ��ʾ���װ�õ����������У�����ȡ����Ǧ��ʹ��ȡҺ�е�FeCl3���������������еĵ缫��ӦʽΪ___________�����õ��װ�õ���ӵ�ԴΪǦ���أ�ÿ����20.7gǦ��Ǧ������������������ʵ���Ϊ___________��

(6)Ŀǰ��Ǧ�����Ի�Ϊ������ʪ����ǦҲ�������Ե��ŵ㣬���ŵ���___________��
���𰸡�2PbS+3O2![]() 2PbO+2SO2 ����ԭ�� SO2+2NH3H2O=SO32- + 2NH4++H2O PbS+2Fe3++4Cl- = S��+PbCl42-+2Fe2+ ϡ��������PbCl2(aq)+2Cl-(aq)
2PbO+2SO2 ����ԭ�� SO2+2NH3H2O=SO32- + 2NH4++H2O PbS+2Fe3++4Cl- = S��+PbCl42-+2Fe2+ ϡ��������PbCl2(aq)+2Cl-(aq)![]() PbCl42-(aq)��ƽ�����ƣ�ʹPbCl2���ʵ���������ȴʹPbCl2���ܽ�ȼ��٣�������PbCl2������ PbCl42-+2e- = Pb+4Cl- 0.2mol ����������Ⱦ�١�����ԭ�Ͽ�ѭ�����á����������ʸߣ��ش�һ�����ɣ�
PbCl42-(aq)��ƽ�����ƣ�ʹPbCl2���ʵ���������ȴʹPbCl2���ܽ�ȼ��٣�������PbCl2������ PbCl42-+2e- = Pb+4Cl- 0.2mol ����������Ⱦ�١�����ԭ�Ͽ�ѭ�����á����������ʸߣ��ش�һ�����ɣ�
��������
��1������¯�з�������PbS��������Ӧ����PbO��SO2��
��2���ķ�¯�н�̿������������ԭ�����������з�������SO2������ˮ�ķ�Ӧ������������狀�ˮ��
��3�������̿�֪����ȡ�����з�������PbS�ͽ�ȡҺ�ķ�Ӧ��Fe3+����ԭΪFe2+,-2��S������ΪS���ʡ�
��4������ˮ�Ժ�������Ũ�ȼ�С������ƽ�����ƣ��ɱ���ã�����PbCl2�ܽ�Ƚ��ͣ��ٽ�PbCl2������
��5���˵��װ��Ŀ������ȡǦ����Һ3�������ң���Һ3�к���PbCl42���������õ��ӷ�����ԭ��Ӧ��
��6����Ǧ�����Ի�Ϊ������ʪ����ǦҲ�������Ե��ŵ㣬���ŵ��Ǹ���������Ⱦ�١�����ԭ�Ͽ�ѭ�����á����������ʸߡ�
��1������¯�з�������PbS��������Ӧ����PbO��SO2����Ӧ�Ļ�ѧ����ʽΪ2PbS+3O2![]() 2PbO+2SO2���ʴ�Ϊ��2PbS+3O2
2PbO+2SO2���ʴ�Ϊ��2PbS+3O2![]() 2PbO+2SO2��
2PbO+2SO2��
��2���ķ�¯�н�̿������������ԭ�����������з�������SO2������ˮ�ķ�Ӧ������������狀�ˮ�������Ļ�ѧ����ʽΪSO2+2NH3H2O=(NH4)2SO3+H2O�����ӷ���ʽΪ��SO2+2NH3H2O=SO32-+2NH4++H2O ���ʴ�Ϊ����ԭ����SO2+2NH3H2O=SO32-+2NH4++H2O��
��3�������̿�֪����ȡ�����з�������PbS�ͽ�ȡҺ�ķ�Ӧ��Fe3+����ԭΪFe2+,-2��S������ΪS���ʣ����ӷ���ʽΪ��PbS+2Fe3++4Cl- = S��+PbCl42-+2Fe2+���ʴ�Ϊ��PbS+2Fe3++4Cl- = S��+PbCl42-+2Fe2+��
��4������ˮ�Ժ�������Ũ�ȼ�С������ƽ�����ƣ��ɱ���ã�����PbCl2�ܽ�Ƚ��ͣ��ٽ�PbCl2�������ʴ�Ϊ��ϡ��������PbCl2(aq)+2Cl-(aq)![]() PbCl42-(aq)��ƽ�����ƣ�ʹPbCl2���ʵ���������ȴʹPbCl2���ܽ�ȼ��٣�������PbCl2��������
PbCl42-(aq)��ƽ�����ƣ�ʹPbCl2���ʵ���������ȴʹPbCl2���ܽ�ȼ��٣�������PbCl2��������
��5���˵��װ��Ŀ������ȡǦ����Һ3�������ң���Һ3�к���PbCl42���������õ��ӷ�����ԭ��Ӧ���������еĵ缫��ӦʽΪPbCl42-+2e- = Pb+4Cl-������Ǧ���صĹ���ԭ��
Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O���ó�Pb��2H2SO4��20.7gǦ���ʵ���Ϊ0.1mol���������ĵ���������ʵ���Ϊ0.2mol���ʴ�Ϊ��PbCl42-+2e- = Pb+4Cl-��0.2mol��
2PbSO4+2H2O���ó�Pb��2H2SO4��20.7gǦ���ʵ���Ϊ0.1mol���������ĵ���������ʵ���Ϊ0.2mol���ʴ�Ϊ��PbCl42-+2e- = Pb+4Cl-��0.2mol��
��6����Ǧ�����Ի�Ϊ������ʪ����ǦҲ�������Ե��ŵ㣬���ŵ��Ǹ���������Ⱦ�١�����ԭ�Ͽ�ѭ�����á����������ʸߣ��ʴ�Ϊ������������Ⱦ�١�����ԭ�Ͽ�ѭ�����á����������ʸߡ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��Ŀ����װ�û�������һ�µ��� �� ��

A. �����ᴿ��ѡ�ٺ͢� B. ʵ������ȡ����ˮ��ѡ��
C. ��CC14��ȡ��ˮ�еĵ⣬ѡ�� D. ����Na2CO3��Һ��CH3COOC2H5��ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У���Ӧ2X��g��+Y2��g��![]() 2XY��g������H��0���ﵽ��ƽ�⣮�ڽ��ı�ijһ�����ﵽ��ƽ�⣬���з�����ȷ����
2XY��g������H��0���ﵽ��ƽ�⣮�ڽ��ı�ijһ�����ﵽ��ƽ�⣬���з�����ȷ����

A. ͼI�У��ס��ҵ�ƽ�ⳣ���ֱ�ΪK1��K2����K1��K2
B. ͼ���У�ƽ��״̬��������ȣ�ƽ��״̬�ķ�Ӧ��ת���ʵ�
C. ͼ���У�tʱ����������ѹǿ
D. ͼ���Ƿ�Ӧ�ֱ��ڼס��������´ﵽƽ�⣬˵�����¶ȸ��ڼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(H3PO2)��һ�־�ϸ������Ʒ������һԪ���ᣬ���н�ǿ�Ļ�ԭ��,�����й�˵����ȷ����
A. H3PO2����ˮ�ĵ��뷽��ʽΪ��H3PO2 ![]() 3H++PO23-
3H++PO23-
B. H3PO2�����NaOH��Һ��Ӧ�����ӷ���ʽΪ��H3PO2+3OH-=PO23-+3H2O
C. ��H3PO2��Һ���뵽���Ը��������Һ�У�H3PO2����������ΪH3PO4
D. �ö��Ե缫���NaH2PO2��Һ����������ӦʽΪ��H2PO2--4e-+2H2O=O2+6H++PO23-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ�������ӽ���Ĥȼ�ϵ�ؽ���ѧ��ת��ɵ��ܵ�ͬʱ��ʵ���������ᡢ���硢������λһ��Ľ�ϣ���ԭ����ͼ��ʾ������˵���������

A. �����ĵ缫��ӦʽΪSO2+2H2O��2e��=SO42��+4H+
B. ��Ӧ��ʽΪ2SO2+O2+2H2O=2H2SO4
C. ���ӵ��ƶ�����Ϊ�ӵ缫B���缫A
D. SO2�����ٶȵĴ�С����Ӱ���صĵ綯��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.ij�¶��£���2L���ܱ�������Ͷ��һ������A��B������Ӧ��3A(g)+bB(g) ![]() cC(g) ��H = ��QkJ��mol��1(Q>0)��12sʱ�ﵽƽ�⣬����C�����ʵ���Ϊ0.8mol����Ӧ��������ͼ��ʾ��
cC(g) ��H = ��QkJ��mol��1(Q>0)��12sʱ�ﵽƽ�⣬����C�����ʵ���Ϊ0.8mol����Ӧ��������ͼ��ʾ��
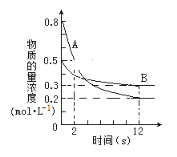
(1)��ѧ������b:c=_______
(2)ǰ12s�ڣ�A��ƽ����Ӧ����Ϊ________________
(3)12s�ڣ�A��B��Ӧ�ų�������Ϊ__________
��.��֪:Cu+2FeCl3=2FeCl2+CuCl2������һ��Ӧ�������һ��ԭ��أ�ָ���缫�������ƣ���д���缫��Ӧʽ
������__________ �缫��Ӧ��__________________
������__________ �缫��Ӧ��__________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʹҩ��![]() �ĺϳɷ������£�
�ĺϳɷ������£�

��֪��
(1)![]() ������Ϊ_________________���ڵķ�Ӧ����Ϊ_________________��Ӧ��
������Ϊ_________________���ڵķ�Ӧ����Ϊ_________________��Ӧ��
(2)![]() �Ľṹ��ʽΪ_________________.
�Ľṹ��ʽΪ_________________.![]() �к��������ŵ�����Ϊ_________________.
�к��������ŵ�����Ϊ_________________.
(3)�۵Ļ�ѧ����ʽΪ__________________________________��
(4)�л���![]() ������ɱ�
������ɱ�![]() ��������ԭ�ӣ���������Ҫ���
��������ԭ�ӣ���������Ҫ���![]() ��ͬ���칹����_________�֡�
��ͬ���칹����_________�֡�
A ��![]() ����ɫ B ������������ȡ����
����ɫ B ������������ȡ����
(5)��֪����һ���ķ�Ӧ�ȣ���Ӧ����ʱ�������(![]() �������л���)�����
�������л���)�����![]() �IJ��ʣ�ԭ����___________________________________________________��
�IJ��ʣ�ԭ����___________________________________________________��
(6) ����һ����Ҫ�Ļ����м��塣�Ի�����(
����һ����Ҫ�Ļ����м��塣�Ի�����(![]() )���Ҵ�Ϊ��ʼԭ�ϣ���ϼ�֪��Ϣѡ���Ҫ�����Լ���д��
)���Ҵ�Ϊ��ʼԭ�ϣ���ϼ�֪��Ϣѡ���Ҫ�����Լ���д�� �ĺϳ�·�ߡ�
�ĺϳ�·�ߡ�
(��֪��![]()
![]() ��
��![]() Ϊ�������ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ����)________________________________
Ϊ�������ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ����)________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Դ�����ö�����̼�����ɼ�������������ŷţ��������»��ȼ�ϻ���Ҫ��ҵ��Ʒ��
��1���п�ѧ�����������FeO���պ�����CO2������Ȼ�ѧ����ʽ��6 FeO(s)+CO2(g)=2Fe3O4(s)+C(s)����H= -76.0 kJ��molһ1
��������Ӧ��ÿ����1 mol Fe3O4��ת�Ƶ��ӵ����ʵ���Ϊ_______mol��
����֪��C(s)+2H2O(g)=CO2 (g)+2H2(g)����H=+113.4 kJ��molһ1����Ӧ��3 FeO(s)+ H2O (g)= Fe3O4 (s)+ H2 (g)�ġ�H=__________��
��2����һ�������£�������̼ת��Ϊ����ķ�Ӧ���£�CO2(g)+4 H2 (g) ![]() C H4 (g)+2 H2O(g)����һ�ݻ�Ϊ 2 L�ĺ����ܱ������г���һ������CO2��H2���� 300��ʱ����������Ӧ���ﵽƽ��ʱ�����ʵ�Ũ�ȷֱ�ΪCO2 0.2 mol��Lһ1�� H2 0.8 mol��Lһ1��CH40.8 mol��Lһ1��H2O1.6 mol��Lһ1����300��ʱ������Ӧ��ƽ�ⳣ��K=____________________�� 200��ʱ�÷�Ӧ��ƽ�ⳣ��K=64.8����÷�Ӧ�ġ�H_____ (�>������<��)0��
C H4 (g)+2 H2O(g)����һ�ݻ�Ϊ 2 L�ĺ����ܱ������г���һ������CO2��H2���� 300��ʱ����������Ӧ���ﵽƽ��ʱ�����ʵ�Ũ�ȷֱ�ΪCO2 0.2 mol��Lһ1�� H2 0.8 mol��Lһ1��CH40.8 mol��Lһ1��H2O1.6 mol��Lһ1����300��ʱ������Ӧ��ƽ�ⳣ��K=____________________�� 200��ʱ�÷�Ӧ��ƽ�ⳣ��K=64.8����÷�Ӧ�ġ�H_____ (�>������<��)0��
��3����ʢ�ٴ�ѧ���о���Ա�о���һ�ַ�������ʵ��ˮ������ʱCO2���ŷţ������ԭ����ͼ��ʾ��

�������������̵�����ת����ʽ��_____________��
a������ת��Ϊ��ѧ�� b��̫����ת��Ϊ����
c��̫����ת��Ϊ��ѧ�� d����ѧ��ת��Ϊ����
��������ⷴӦ���¶�С�� 900��ʱ���У�̼����ȷֽ�ΪCaO��CO2�������Ϊ����̼���ƣ�������ӦʽΪ3CO2��4e��=C��2CO32-���������ĵ缫��ӦʽΪ______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴ӦaA(s)+bB(g)![]() cC(g) +dD(g)�� ��������������ʱ��ij�����ڻ�����еĺ������¶�(T)��ѹǿ(p)�Ĺ�ϵ��ͼ��ʾ��������ȷ���ǣ� ��
cC(g) +dD(g)�� ��������������ʱ��ij�����ڻ�����еĺ������¶�(T)��ѹǿ(p)�Ĺ�ϵ��ͼ��ʾ��������ȷ���ǣ� ��
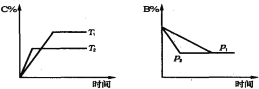
A. T1>T2������Ӧ����
B. Tl<T2������Ӧ����
C. P1>P2��a+b>c+d
D. Pl��P2��b=c+d
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com