
【题目】二氧化硫一空气质子交换膜燃料电池将化学能转变成电能的同时,实现了制硫酸、发电、环保三位一体的结合,其原理如图所示。下列说法错误的是

A. 负极的电极反应式为SO2+2H2O-2e-=SO42-+4H+
B. 反应总式为2SO2+O2+2H2O=2H2SO4
C. 质子的移动方向为从电极B到电极A
D. SO2气流速度的大小可能影响电池的电动势
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中,有一个左右可滑动隔板,两边分别进行可逆反应,各物质的量如下:M、N、P为2.5mol、3.0mol、1.0mol。A、C、D各为0.50mol,B的物质的量为x,当x的物质的量在一定范围内变化,均可以通过调节反应器的温度,使两侧反应均达到平衡,且隔板在反应器的正中位置。达到平衡后,测得M的转化率为75%,填写空白:
![]()
(1)达到平衡后,反应器左室气体总的物质的量为____________________mol。
(2)若要使右室反应开始时V正>V逆,x的取值范围_____________________。
(3)若要使右室反应开始时V正<V逆,x的取值范围_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用钢铁厂烟灰(含Fe、Mn、SiO2,少量的Al2O3、CaO及MgO)制备MnCO3的工艺流程如下:
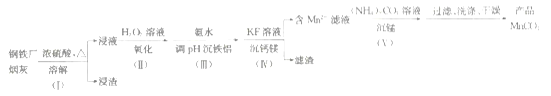
已知25℃时,下列难溶物的溶度积常数:
难溶物 | CaF2 | MgF2 | MnCO3 | Mn(OH)2 |
Ksp | 4.0×10-11 | 6.4×10-9 | 2.2×10-11 | 1.9×10-13 |
回答下列问题:
(1)步骤(Ⅰ)浸渣的主要成分是______________(填化学式)。
(2)步骤(Ⅱ)加H2O2溶液时反应的离子方程式为________________;
加氨水调节pH沉铁铝时,步骤(Ⅲ)应调节的pH适宜范围为____________。(部分金属离子开始沉淀与沉淀完全的pH范围如下)
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Mg2+ |
沉淀pH范围 | 7.6~9.6 | 2.7~3.7 | 3.4~5.2 | 8.3~9.3 | 9.6~11.1 |
(3)步骤(Ⅳ)用KF溶液沉钙镁时,要使c(Ca2+)、c(Mg2+)均小于1×10-6mol·L-1,则应控制反应液中c(F-)>___________mol·L-1;反应MgF2(s)+Ca2+![]() CaF2(s)+Mg2+的平衡常数K=___________。
CaF2(s)+Mg2+的平衡常数K=___________。
(4)步骤Ⅴ沉锰时,在60℃按投料比n[(NH4)2CO3]/n(Mn2+)=2,溶液的pH对MnCO3产率的影响如图所示;pH=7,按投料比n[(NH4)2CO3]/n(Mn2+)=2,反应温度对MnCO3产率的影响如图所示。
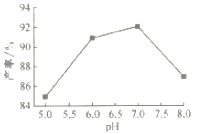
①上图中,在pH<7.0时,pH越小产率____________(填“越高”或“越低”;在pH>7.0时,pH越大产率越低且纯度也降低,其原因是___________________。

②上图中,温度高于60℃时,温度越高产率越低且纯度也越低,主要原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化合物的治理是环保的一项重要工作,合理应用和处理氮的化合物,在生产生活中有着重要的意义。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+181.5 kJ·mol-1某科研小组尝试利用固体表面催化工艺进行NO的分解。若用●● 、●○ 、○○和![]() 分别表示N2 、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如下图所示。从吸附到解吸的过程中,能量状态最低的是___________(填字母序号)。
分别表示N2 、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如下图所示。从吸附到解吸的过程中,能量状态最低的是___________(填字母序号)。

(2)为减少汽车尾气中NOx的排放,常采用CxHy(烃)催化还原NOx消除氮氧化物的污染。
例如:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
②CH4(g)+4NO(g)=2N2 (g)+CO2 (g)+2H2O(g) △H2=-1160 kJ/mol
③CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H3
则△H3=___________。
(3)亚硝酰氯(ClNO)是有机合成中常用试剂,已知:2NO(g)+Cl2(g)![]() 2 ClNO(g) △H<0
2 ClNO(g) △H<0
①一定温度下,将2 molNO与2 molCl2置于2L密闭容器中发生反应,若该反应4min后达平衡,此时压强是初始的0.8倍,则平均反应速率v(Cl2)=___________mol·L-1·min-1。下列可判断反应达平衡状态的是___________(项序号字母)。
A 混合气体的平均相对分子质量不变
B 混合气体密度保持不变
C NO和Cl2的物质的量之比保持不变
D 每消耗1 moI NO同时生成1molClNO
②为了加快化学反应速率,同时提高NO的转化率,其他条件不变时,可采取的措施有___________(填选项序号字母)。
A 升高温度 B 缩小容器体积
C 再充入Cl2气体 D 使用合适的催化剂
③一定条件下在恒温恒容的密闭容器中,按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图(b)所示,当n(NO)/n(Cl2)=2.5时,达到平衡状态,ClNO的体积分数可能是图中D、E、F三点中的___________点。

(4)已知2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快),v1正=k1正c2(NO),v1逆 =k1逆c (N2O2)
N2O2(g)(快),v1正=k1正c2(NO),v1逆 =k1逆c (N2O2)
②N2O2(g)+O2(g)![]() 2NO2(g)(慢),v2正=k2正c(N2O2)·c(O2),v2逆=k2逆c2(NO2)
2NO2(g)(慢),v2正=k2正c(N2O2)·c(O2),v2逆=k2逆c2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小:E1___________E2(填“>”、"<”或“=”):2NO(g)+O2(g)![]() 2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为___________。
2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素的基态原子的核外电子有3种能量状态、5种空间状态,X是其中第一电离能最小的元素;元素Y的M层电子运动状态与X的价电子运动状态相同;元素Z位于第四周期,其基态原子的2价阳离子M层轨道全部排满电子。
(1)X基态原子的电子排布式为___________。
(2)X的氢化物(H2X)在乙醇中的溶解度大于H2Y,其原因是___________。
(3)在Y的氢化物(H2Y分子中,Y原子轨道的杂化类型是___________。
(4)Y与X可形成YX32-。
①YX32-的立体构型为___________(用文字描述)。
②写出一种与YX32-互为等电子体的分子的化学式___________。
(5)Z的氯化物与氨水反应可形成配合物[Z(NH3)4(H2O)2]Cl2,该配合物加热时,首先失去配离子中的配体是___________(写化学式)。

(6)Y与Z所形成化合物晶体的晶胞如图所示,该化合物的化学式为___________。其晶胞边长为540.0pm,密度为___________g·cm-3(列式并计算),a位置Y与b位置Z之间的距离为___________pm(列式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅是人类较早发现和使用的一种重金属,工业上用铅精矿(主要成分含PbS)为原料,分火法和湿法两种方法冶炼。
Ⅰ.火法冶炼粗铅的流程如下:

(1)焙烧炉中主要反应的化学方程式为______________________。
(2)鼓风炉中焦炭的作用是___________,吸收塔中反应的离子方程式为___________。
Ⅱ.湿法炼铅的工艺流程如下:

已知:①不同温度下PbCl2的溶解度如下表所示。

②PbCl2为能溶于水的弱电解质,在含Cl-的溶液中存在平衡:
PbCl2(aq)+2Cl-(aq)![]() PbCl42-(aq)。
PbCl42-(aq)。
(3)浸取过程中发生反应的离子方程式为______________________。
(4)操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出,其合理的解释为___________。
(5)将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。则阴极室中的电极反应式为___________;若该电解装置的外接电源为铅蓄电池,每生成20.7g铅,铅蓄电池中消耗硫酸的物质的量为___________。

(6)目前炼铅工艺以火法为主,但湿法炼铅也有其明显的优点,其优点是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、火力发电厂释放出大量氮氧化合物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+ 4NO2(g)=4NO(g)+ CO2(g)+ 2H2O(g) △H1=-574 kJ/mol
CH4(g)+ 4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) △H2=-1160 kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为__________________________。
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3
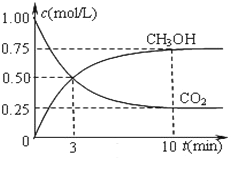
在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行反应。测得CO2和CH3OH(g)浓度随时间变化如图所示。回答:0~10 min内,氢气的平均反应速率为___mol/(L·S);第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡_________(填“正向”、“逆向”或“不”)移动。
Ⅱ、如下图所示C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。
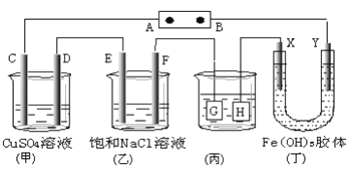
(1)若用甲醇、空气燃料电池作电源,电解质为KOH溶液,则A极的电极反应式为_________________________
(2)欲用(丙)装置给铜镀银,银应该是 _____电极(填G或H)
(3)(丁)装置中Y极附近红褐色变_______(填深或浅)
(4)通电一段时间后,C、D、E、F电极均有单质生成,其物质的量之比为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别用0.1 mol·L-1溶液进行下列实验,结论不正确的是
A. 向NaHCO3溶液中通CO2至pH=7:c(Na+) = c(HCO3-) +2c(CO32-)
B. 向CH3COONa溶液中加入等浓度等体积的盐酸:c(Na+)=c(Cl![]() )
)
C. 向NaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液:pH=13
D. 向氨水中加入少量NH4Cl固体:![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某课外活动小组将下图所示装置按一定顺序连接,在实验室里制取一定量的FeCl3(所通气体过量并充分反应)。请回答下列问题:
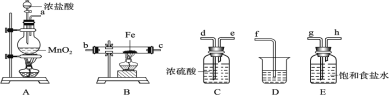
(1)A 中发生反应的化学方程式为________________________。在该反应中当 0.4molHCl发生反应时,生成标准状况下的Cl2 的体积为______。浓盐酸在反应中显示出来的性质是__(填序号);
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)各装置的正确连接顺序为(填写装置代号)A→_____→_____→_____→D。
(3)装置 E 的作用是_______。写出装置 D(D中所盛溶液为 NaOH)中反应的化学方程式_______
(4)工业上用电解法制备氯气的化学方程式为:____________。
Ⅱ.某小组用CCl4萃取碘水中的碘,在下图的分液漏斗中,下层液体呈__________色;他们打开分液漏斗活塞,却未见液体流下,原因可能是__________________
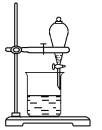
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com