
【题目】铁、钴、镍都属于第Ⅷ族元素,它们的单质、合金及其化合物在催化剂和能源领域用途非常广泛。
(1)基态Fe2+的核外电子排布式为__。结合电子排布式分析Fe3+比Co3+氧化性弱的原因:__。
(2)BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为__。
②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co3+形成配位键的原子是__。(已知CO32-的结构式为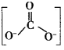 )
)
③NaNT可以![]() (双聚氰胺)为原料制备,双聚氰胺中碳原子杂化轨道类型为__,1mol
(双聚氰胺)为原料制备,双聚氰胺中碳原子杂化轨道类型为__,1mol![]() 中含有σ键的物质的量为__。
中含有σ键的物质的量为__。
④[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为__。
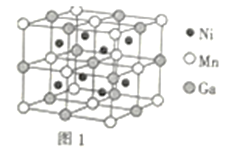
(3)一种新型的功能材料的晶胞结构如图1所示,它的化学式可表示为___。晶胞中离1个Mn原子最近的Ni原子有__个。
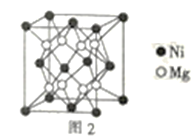
(4)镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图2所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm,则镍镁晶体未储氢时的密度为__(列出计算表达式,NA表示阿伏加德罗常数的数值)gcm-3。
【答案】[Ar]3d6(或1s22s22p63s23p63d6) Fe3+的基态电子排布式为3d5,Co3+的基态电子排布式为3d6,Fe3+具有半充满结构,而Co3+不具备半充满结构,因此Fe3+氧化性比Co3+弱 正四面体 N和O sp和sp2 9mol N2H4与H2O之间可以形成氢键 Ni2MnGa 8 ![]()
【解析】
(1)基态Fe的电子排布式为[Ar]3d64s2(或1s22s22p63s23p63d64s2),则基态Fe2+的核外电子排布式为[Ar]3d6(或1s22s22p63s23p63d6)。利用价电子排布式判断价电子层是否达稳定状态,可得出Fe3+比Co3+氧化性弱的原因是Fe3+的基态电子排布式为3d5,Co3+的基态电子排布式为3d6,Fe3+具有半充满结构,而Co3+不具备半充满结构,因此Fe3+氧化性比Co3+弱。 (2)①ClO4-中,Cl的价层电子对数为4,且不存在孤对电子,由此可推出空间构型为正四面体。答案为:正四面体;
②CTCN的化学式为[Co(NH3)4CO3]NO3,配体为NH3和CO32-,则与Co3+形成配位键的原子为N和O。答案为:N和O;
③从双聚氰胺的结构中,能得出碳原子的价层电子对数为2和3,则杂化轨道类型为sp和sp2;两个原子间只能形成1个σ键,由结构可确定1mol![]() 中含有σ键的物质的量为9mol。答案为:sp和sp2;9mol;
中含有σ键的物质的量为9mol。答案为:sp和sp2;9mol;
④配体N2H4能与水混溶,除因为它们都是极性分子外,还因为N2H4与H2O之间可以形成氢键。答案为:N2H4与H2O之间可以形成氢键;
(3)晶胞中,Ni原子位于每个小立方体的体心,则晶胞中所含Ni原子个数为8;Mn原子位于顶点和面心,则晶胞中所含Mn原子个数为8×![]() +6×
+6×![]() =4;Ga原子位于体心和棱上,则晶胞中所含Ga原子个数为1+12×
=4;Ga原子位于体心和棱上,则晶胞中所含Ga原子个数为1+12×![]() =4,则化学式为Ni2MnGa。晶胞中,Mn原子在面心,而Ni原子在小立方体的体心,则晶胞中离1个Mn原子最近的Ni原子有8个。答案为:Ni2MnGa;8;
=4,则化学式为Ni2MnGa。晶胞中,Mn原子在面心,而Ni原子在小立方体的体心,则晶胞中离1个Mn原子最近的Ni原子有8个。答案为:Ni2MnGa;8;
(4)每个面的两条相交的棱的中点连线即为“距离最近的两个H2分子之间的距离为anm”,设立方体的边长为x,则a2=(![]() )2+(
)2+(![]() )2,从而求出x=
)2,从而求出x=![]() nm。每个晶胞中含有4个NiMg2,则可求出镍镁晶体未储氢时的密度为
nm。每个晶胞中含有4个NiMg2,则可求出镍镁晶体未储氢时的密度为![]() =
=![]() g/cm3。答案为:
g/cm3。答案为:![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)写出下列有机物的结构简式:
①2,2,3,3四甲基戊烷______________________________________;
②2,5二甲基庚烷_________________________________________;
③2,3二甲基6乙基辛烷___________________________________。
(2)写出下列物质的分子式
①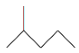 __________________________________;
__________________________________;
②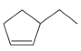 __________________________________。
__________________________________。
(3)写出下列物质的键线式
①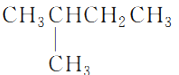 __________________________________;
__________________________________;
②CH3CH=CHCH3__________________________________。
(4)按照系统命名法命名有机物
CH3CH(C2H5)CH(CH3)2_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油酸甘油酯(相对分子质量884)是一种典型的脂肪,在体内代谢时可发生如下反应:C57H104O6(s)+80O2(g)=57CO2(g)+52H2O(l)。已知要消耗1kg该化合物,常人需快走约200公里(每快走1公里按平均耗能190 kJ计)。则油酸甘油酯的燃烧热△H约为( )
A.3.8×104kJ·mol-1B.-3.8×104kJ·mol-1
C.3.4×104kJ·mol-1D.-3.4×104kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列难溶盐的饱和溶液中,Ag+浓度最大的是( )
A.AgCl(Ksp=1.8×10-10 molL﹣1)
B.Ag2CO3(Ksp=8.1×10-12 molL﹣1)
C.Ag2CrO4(Ksp=9.0×10-12 molL﹣1)
D.AgBr(Ksp=5.0×10-13 molL﹣1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,往二元弱酸的钠盐Na2A溶液中通入HCl,溶液中-lg![]() 和-lgc(A2-)的关系如图所示。下列说法正确的是( )
和-lgc(A2-)的关系如图所示。下列说法正确的是( )
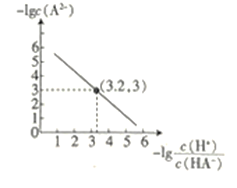
A.K(HA-)的数量级为10-7
B.通入HCl的过程中,水电离出的c(H+)不断增大
C.在Na2A溶液中:c(OH-)= c(H2A)+ c(HA-)+ c(H+)
D.当通入的HCl的物质的量与Na2A的物质的量相等时c(Na+)+ c(H+)= c(HA-)+2 c(A2-)+ c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
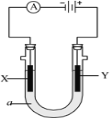
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式是___。在X极附近观察到的现象是___。
②Y电极上的电极反应式是___,检验该电极反应产物的方法是___。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的电极反应式是___。
②Y电极的材料是___。
③假若电路中有0.04摩尔电子通过时,阴极增重___克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酰氯(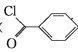 )是制备染料,香料药品和树脂的重要中间体,以光气法制备苯甲酰氯的原理如下(该反应为放热反应):
)是制备染料,香料药品和树脂的重要中间体,以光气法制备苯甲酰氯的原理如下(该反应为放热反应):
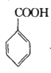 +COCl2
+COCl2![]()
![]() +CO2+HCl
+CO2+HCl
已知物质性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 |
苯甲酸 | 122.1 | 249 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 |
碳酰氯(COCl2) | -188 | 8.2 | 较易溶于苯、甲苯等。遇水迅速水解,生成氯化氢,与氨很快反应,主要生成尿素[CO(NH2)2]和氯化铵等无毒物质 |
苯甲酰氯 | -1 | 197 | 溶于乙醚、氯仿和苯。遇水或乙醇逐渐分解,生成苯甲酸或苯甲酸乙酯和氯化氢 |
三氯甲烷(CHCl3) | -63.5 | 63.1 | 不溶于水,溶于醇、苯。极易挥发,稳定性差,450℃以上发生热分解 |
I.制备碳酰氯
反应原理:2 CHCl3+O2![]() 2HCl+COCl2
2HCl+COCl2
甲. 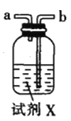 乙.
乙. 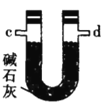 丙.
丙. 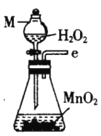 丁.
丁.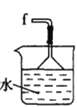 戊.
戊. 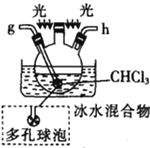
(1)仪器M的名称是____________
(2)按气流由左至右的顺序为___________→c→d→_________→_________→_________→_________→_________.
(3)试剂X是_______________(填名称)。
(4)装置乙中碱石灰的作用是____________。
(5)装置戊中冰水混合物的作用是____________;多孔球泡的作用是________________。
Ⅱ.制备苯甲酰氯(部分夹持装置省略)
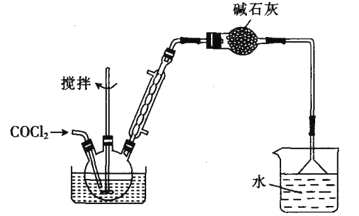
(6)碳酰氯也可以用浓氨水吸收,写出该反应的化学方程式:______________。
若向三颈烧瓶中加入610g苯甲酸,先加热至140~150℃,再通入COCl2,充分反应后,最后产品经减压蒸馏得到562g苯甲酰氯,则苯甲酸的转化率为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H2(g)+ ![]() O2(g)=H2O(g);ΔH1= akJ·mol-1
O2(g)=H2O(g);ΔH1= akJ·mol-1
②2H2(g)+O2(g) = 2H2O(g);ΔH2= b kJ·mol-1 ③ H2(g)+ ![]() O2(g)=H2O(l);ΔH3= c kJ·mol-1
O2(g)=H2O(l);ΔH3= c kJ·mol-1
④2H2(g)+O2(g) = 2H2O(l);ΔH4= d kJ·mol-1,下列关系式中正确的是( )
A.2a=b<0B.b>d>0C.a<c<0D.2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在科学家正在寻求将太阳能转化成化学能的办法,其中办法之一就是利用太阳能将H2O分解成H2,再将化学能转化为其他能源。如图是有关的能量循环示意图,下列有关说法正确的是( )
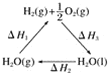
A.图中ΔH1=ΔH2+ΔH3
B.如果H—H的键能为akJ·mol-1,O=O键能为bkJ·mol-1,则断开1 mol H—O键所需要的太阳能为(ΔH1+a+b) kJ
C.1 mol H2燃烧生成液态水放出|ΔH3| kJ的热量
D.水蒸气所具有的能量比液态水多ΔH2kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com