
【题目】下列难溶盐的饱和溶液中,Ag+浓度最大的是( )
A.AgCl(Ksp=1.8×10-10 molL﹣1)
B.Ag2CO3(Ksp=8.1×10-12 molL﹣1)
C.Ag2CrO4(Ksp=9.0×10-12 molL﹣1)
D.AgBr(Ksp=5.0×10-13 molL﹣1)
科目:高中化学 来源: 题型:
【题目】科学家正在研究温室气体CH4和CO2的转化和利用。
(1)O原子核外电子的运动状态有____种。
(2)CH4和CO2所含的三种元素电负性从小到大的顺序为____。
(3)下列关于CH4和CO2的说法正确的是____(填序号)。
a.固态CO2属于分子晶体,在晶体中一个CO2分子周围有12个紧邻的CO2分子
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d.CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(4)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2
①基态Ni原子的电子排布式为____,该元素位于元素周期表的第____周期____族。
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有____mol σ键。
(5)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物俗称“可燃冰”。
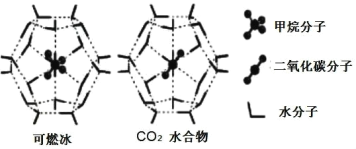
①“可燃冰”中分子间存在的2种作用力是____。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
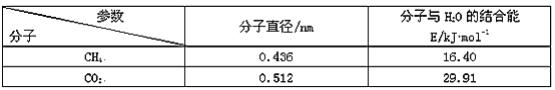
【题目】通过反应“P4(s)+3NaOH(aq)+3H2O(l)=3NaH2PO2(aq)+PH3(g) ΔH>0”,能制得用于化学镀镍的NaH2PO2。P4的结构如图所示,则下列说法正确的是
A.白磷中各P原子通过共价键相连接形成共价晶体
B.H2O分子的立体构型为V形
C.该反应能自发进行,则ΔS<0
D.反应产物PH3中磷原子的杂化方式为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是天然气的主要成分,是一种重要的清洁能源和化工原料。
(1)用煤制天然气时会发生多个反应,通过多种途径生成CH4。
已知:C(s)十2H2(g) ![]() CH4(g) △H=-73kJ/mol
CH4(g) △H=-73kJ/mol
2CO(g) ![]() C(s)+CO2(g) △H=-171kJ/mol
C(s)+CO2(g) △H=-171kJ/mol
CO(g)十3H2(g) ![]() CH4(g)+H2O(g) △H=-203kJ/mol。
CH4(g)+H2O(g) △H=-203kJ/mol。
写出CO(g) 与H2O(g) 反应生成H 2(g) 和CO2(g) 的热化学方程式____________。
(2)天然气中含有H2S杂质,某科研小组用氨水吸收得到NH4HS溶液,已知T℃k(NH3·H2O) =1.74×10-5; k1(H2S) =1.07×10-7, k2(H2S) =1.74×10-13,NH4HS溶液中所含粒子浓度大小关系正确的是____________。
A c(NH4+)>c(HS-)>c(OH-) >c(H+)
B c(HS-) > c(NH4+)> (S2-) >c(H+)
C c(NH4+)>c(HS-) >c(H2S) >c(H+)
D c(HS-) >c(S2-) >c(H+)>c(OH-)
(3)工业上常用CH4与水蒸气在一定条件下来制取H2,其原理为: CH4(g)+H2O(g) ![]() CO(g)+3H2(g)
CO(g)+3H2(g)
①一定温度时, 在一个体积为2L的恒容密闭容器中, 加入1molCH4和1.4mol水蒸气发生上述反应, 5min后达平衡, 生成0.2mol CO, 用H2表示该反应的速率为____________。此反应的平衡常数为____________(结果保留到小数点后三位)。
②下列说法中能说明此反应达到平衡状态的是____________。
A 体系的压强不再发生变化
B 生成1molCH4的同时消耗3molH2
C 各组分的物质的量浓度不再改变
D 体系的密度不再发生变化
E 反应速率V(CH4):V(H2O):u(CO):u(H2)=1:1:1:3
(4)甲醇水蒸气重整制氢反应:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49kJ/mol。某温度下, 将[n(H2O) :n(CH3OH) ] =1:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国制造彰显中国力量,在电影《厉害了,我的国》中重点介绍了中国制造的重点工程,下列所涉及的材料不属于无机非金属材料的是( )
世界最大射电望远镜“中国天眼” |
“嫦娥四号”月球探测器 |
中国大飞机C919 |
中国第一艘深海载人潜水器“蛟龙号” |
A.光导纤维传输线 | B.晶体硅芯片 | C.新型铝锂合金机翼 | D.氮化硅陶瓷发动机 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从废钴酸锂电池正极片(LiCoO2、乙炔炭黑、Al箔)中回收钴和锂的流程如图:下列说法错误的是( )
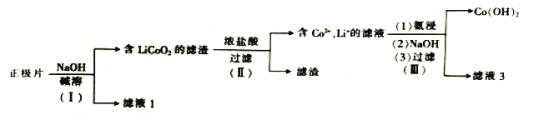
A.步骤(Ⅰ)中的滤液1中含有AlO2-
B.步骤(Ⅱ)中的浓盐酸可用浓硝酸代替
C.步骤(Ⅲ)中的滤液3可用于回收锂
D.合理处理废旧电池有利于保护环境和资源再利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍都属于第Ⅷ族元素,它们的单质、合金及其化合物在催化剂和能源领域用途非常广泛。
(1)基态Fe2+的核外电子排布式为__。结合电子排布式分析Fe3+比Co3+氧化性弱的原因:__。
(2)BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为__。
②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co3+形成配位键的原子是__。(已知CO32-的结构式为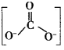 )
)
③NaNT可以![]() (双聚氰胺)为原料制备,双聚氰胺中碳原子杂化轨道类型为__,1mol
(双聚氰胺)为原料制备,双聚氰胺中碳原子杂化轨道类型为__,1mol![]() 中含有σ键的物质的量为__。
中含有σ键的物质的量为__。
④[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为__。
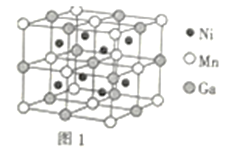
(3)一种新型的功能材料的晶胞结构如图1所示,它的化学式可表示为___。晶胞中离1个Mn原子最近的Ni原子有__个。
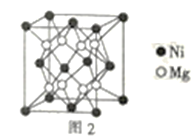
(4)镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图2所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm,则镍镁晶体未储氢时的密度为__(列出计算表达式,NA表示阿伏加德罗常数的数值)gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.一般沉淀离子浓度小于10-5mol·L-1时,则认为已经沉淀完全
B.反应AgCl+NaBr=AgBr+NaCl能在水溶液中能进行,是因为AgCl比AgBr更难溶于水
C.Al(OH)3(s)![]() Al3+(aq)+3OH-(aq)表示沉淀溶解平衡,Al(OH)3
Al3+(aq)+3OH-(aq)表示沉淀溶解平衡,Al(OH)3![]() Al3++3OH-表示水解平衡
Al3++3OH-表示水解平衡
D.只有反应速率很高的化学反应才能应用于工业生产
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物TPE具有聚集诱导发光特性,在光电材料领域应用前景广阔,其结构简式如下图所示。下列有关该有机物说法正确的是
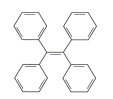
A. 分子式为C26H22 B. 属于苯的同系物
C. 一氯代物有3种 D. 能溶于水和酒精
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com