
【题目】从废钴酸锂电池正极片(LiCoO2、乙炔炭黑、Al箔)中回收钴和锂的流程如图:下列说法错误的是( )
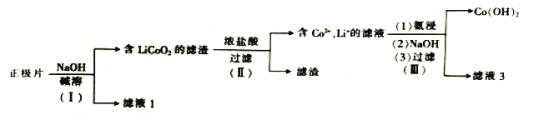
A.步骤(Ⅰ)中的滤液1中含有AlO2-
B.步骤(Ⅱ)中的浓盐酸可用浓硝酸代替
C.步骤(Ⅲ)中的滤液3可用于回收锂
D.合理处理废旧电池有利于保护环境和资源再利用
【答案】B
【解析】
废钴酸锂电池正极片(LiCoO2、乙炔炭黑、Al箔)中加入NaOH溶液碱溶,此时只有Al转化为NaAlO2进入滤液1中,滤渣为LiCoO2、乙炔炭黑;加入浓盐酸,乙炔炭黑不反应,进入滤渣,LiCoO2被浓盐酸还原,Co由+3价转化为Co2+,同时生成Li+和Cl2;经过氨浸、NaOH处理后,Co2+生成Co(OH)2沉淀,Li+进入滤液中。
A.由以上分析可知,步骤(Ⅰ)的滤液1中含有AlO2-,A正确;
B.步骤(Ⅱ)中的浓盐酸若用浓硝酸代替,则无法将钴由+3价还原为Co2+,B错误;
C.步骤(Ⅲ)中的滤液3中含有Li+,可用于回收锂,C正确;
D.废旧电池中含有锂、钴等可回收利用的资源,有利于保护环境和资源再利用,D正确;
故选B。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. ![]() 的一溴代物和
的一溴代物和![]() 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)
B. CH3CH=CHCH3分子中的四个碳原子在同一直线上
C. 按系统命名法,化合物 的名称是2,3,4-三甲基-2-乙基戊烷
的名称是2,3,4-三甲基-2-乙基戊烷
D. ![]() 与
与![]() 都是α-氨基酸且互为同系物
都是α-氨基酸且互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
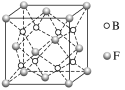
【题目】已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B,C、D与E分别位于同一周期。A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体。
(1)请写出F离子的电子排布式_________。
(2)写出X的化学式________,X的化学名称为______。
(3)写出X涉及化工生产中的一个化学方程式:__________。
(4)试解释工业冶炼D不以DE3而是以D2A3为原料的原因:____________。
(5)F与B可形成离子化合物,其晶胞结构如图所示。F与B形成的离子化合物的化学式为__________;该离子化合物晶体的密度为a g·cm-3,则晶胞的体积是________(只要求列出算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种制备草酸铁铵晶体[(NH4)3Fe(C2O4)3]的工艺流程如下:
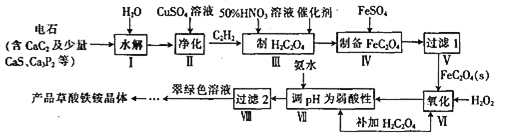
回答下列问题:
(1)CaC2的电子式为__________
(2)步骤Ⅱ主要是除去H2S、PH3等杂质气体。在除PH3时,PH3被氧化为H3PO4,CuSO4被还原为Cu,该反应中氧化剂与还原剂的物质的量之比为____________
(3)步骤Ⅲ制H2C2O4时需要加热硝酸的还原产物为NO,该反应的化学方程式为______________,硝酸的浓度及反应温度都不宜过高,是因为____________.
(4)“过滤1”需对沉淀进行洗涤检验其是否洗涤干净的依据是____________________
(5)步骤Ⅵ、VII补加草酸的目的是______________________.
(6)步骤VIII由滤液制得产品的操作为____________、____________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列难溶盐的饱和溶液中,Ag+浓度最大的是( )
A.AgCl(Ksp=1.8×10-10 molL﹣1)
B.Ag2CO3(Ksp=8.1×10-12 molL﹣1)
C.Ag2CrO4(Ksp=9.0×10-12 molL﹣1)
D.AgBr(Ksp=5.0×10-13 molL﹣1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)和次磷酸钠(NaH2PO2)都具有强还原性,都有着广泛的用途。
(1)已知:①N2H4(1)+O2(g)=N2(g)+2H2O(g) △H1=-621.5kJmol-1
②N2O4(1)=N2(g)+2O2(g) △H2=+204.3kJmol-1
则火箭燃料的燃烧反应为2N2H4(1)+N2O4(1)=3N2(g)+4H2O(g) △H=__。
(2)已知反应N2H4(g)+2Cl2(g)![]() N2(g)+4HCl(g),T℃时,向2L恒容密闭容器中加入2molN2H4(g)和4molCl2(g),测得Cl2和HCl的浓度随时间的关系如图所示。
N2(g)+4HCl(g),T℃时,向2L恒容密闭容器中加入2molN2H4(g)和4molCl2(g),测得Cl2和HCl的浓度随时间的关系如图所示。

①0~10min内,用N2(g)表示的平均反应速率v(N2)=__。
②M点时,N2H4的转化率为__(精确到0.1)%。
③T℃时,达到平衡后再向该容器中加入1.2molN2H4(g)、0.4molCl2(g)、0.8molN2(g)、1.2molHCl(g),此时平衡__(填“正向移动”“逆向移动”或“不移动”)。
(3)①次磷酸(H3PO2)是一元酸,常温下,1.0molL-1的NaH2PO2溶液pH为8,则次磷酸的Ka=__。
②用次磷酸钠通过电渗析法制备次磷酸,装置如图所示。交换膜A属于__(“阳离子”或“阴离子”)交换膜,电极N的电极反应式为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
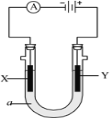
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式是___。在X极附近观察到的现象是___。
②Y电极上的电极反应式是___,检验该电极反应产物的方法是___。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的电极反应式是___。
②Y电极的材料是___。
③假若电路中有0.04摩尔电子通过时,阴极增重___克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,
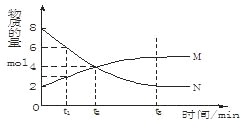
下列表述中正确的是
A.反应的化学方程式为: M![]() NB.t2时,正逆反应速率相等,达到平衡
NB.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率D.t1时,N的浓度是M浓度的2倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com