
【题目】电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
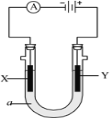
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式是___。在X极附近观察到的现象是___。
②Y电极上的电极反应式是___,检验该电极反应产物的方法是___。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的电极反应式是___。
②Y电极的材料是___。
③假若电路中有0.04摩尔电子通过时,阴极增重___克。
【答案】2H++2e-=H2↑ 放出气体,溶液变红 2Cl--2e-=C2↑ 把湿润的淀粉KI试纸放在Y电极附近,试纸变蓝 Cu2++2e-=Cu 粗铜 1.28
【解析】
(1)电解饱和氯化钠溶液时,由电源可知,X为阴极,Y为阳极,阳极上是氯离子失电子,阴极上是氢离子得电子;
(2)根据电解精炼铜的工作原理知识来回答。
(1)①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,X电极附近水的电离被破坏,氢氧根离子浓度增大,溶液呈红色;
②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl2e=Cl2↑,检验氯气的方法是用湿润的淀粉碘化钾试纸检验生成的气体,气体能使试纸变蓝色;
(2)①电解方法精炼粗铜,X为阴极,电解池的阴极材料是纯铜,电极反应为Cu2++2e-=Cu;
②电解方法精炼粗铜,Y为阳极,电解池的阳极材料是粗铜,电极反应为:Cu2e=Cu2+;
③阴极反应为Cu2++2e-=Cu,当电路中有0.04mol电子通过时,应生成0.02molCu,质量=nM=0.02mol ×64g/mol=1.28g;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. (CH3)3C-CH=CH2与氢气完全反应后,生成2,2,3-三甲基戊烷
B. 工业上由乙烯制乙醇、苯制环己烷均属于加成反应
C. C5H11Cl的同分异构体有3种
D.  分子中所有碳原子一定在同一平面上
分子中所有碳原子一定在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是天然气的主要成分,是一种重要的清洁能源和化工原料。
(1)用煤制天然气时会发生多个反应,通过多种途径生成CH4。
已知:C(s)十2H2(g) ![]() CH4(g) △H=-73kJ/mol
CH4(g) △H=-73kJ/mol
2CO(g) ![]() C(s)+CO2(g) △H=-171kJ/mol
C(s)+CO2(g) △H=-171kJ/mol
CO(g)十3H2(g) ![]() CH4(g)+H2O(g) △H=-203kJ/mol。
CH4(g)+H2O(g) △H=-203kJ/mol。
写出CO(g) 与H2O(g) 反应生成H 2(g) 和CO2(g) 的热化学方程式____________。
(2)天然气中含有H2S杂质,某科研小组用氨水吸收得到NH4HS溶液,已知T℃k(NH3·H2O) =1.74×10-5; k1(H2S) =1.07×10-7, k2(H2S) =1.74×10-13,NH4HS溶液中所含粒子浓度大小关系正确的是____________。
A c(NH4+)>c(HS-)>c(OH-) >c(H+)
B c(HS-) > c(NH4+)> (S2-) >c(H+)
C c(NH4+)>c(HS-) >c(H2S) >c(H+)
D c(HS-) >c(S2-) >c(H+)>c(OH-)
(3)工业上常用CH4与水蒸气在一定条件下来制取H2,其原理为: CH4(g)+H2O(g) ![]() CO(g)+3H2(g)
CO(g)+3H2(g)
①一定温度时, 在一个体积为2L的恒容密闭容器中, 加入1molCH4和1.4mol水蒸气发生上述反应, 5min后达平衡, 生成0.2mol CO, 用H2表示该反应的速率为____________。此反应的平衡常数为____________(结果保留到小数点后三位)。
②下列说法中能说明此反应达到平衡状态的是____________。
A 体系的压强不再发生变化
B 生成1molCH4的同时消耗3molH2
C 各组分的物质的量浓度不再改变
D 体系的密度不再发生变化
E 反应速率V(CH4):V(H2O):u(CO):u(H2)=1:1:1:3
(4)甲醇水蒸气重整制氢反应:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49kJ/mol。某温度下, 将[n(H2O) :n(CH3OH) ] =1:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从废钴酸锂电池正极片(LiCoO2、乙炔炭黑、Al箔)中回收钴和锂的流程如图:下列说法错误的是( )
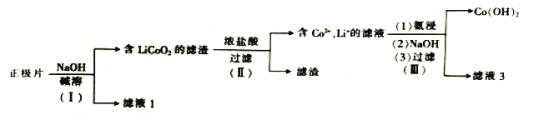
A.步骤(Ⅰ)中的滤液1中含有AlO2-
B.步骤(Ⅱ)中的浓盐酸可用浓硝酸代替
C.步骤(Ⅲ)中的滤液3可用于回收锂
D.合理处理废旧电池有利于保护环境和资源再利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍都属于第Ⅷ族元素,它们的单质、合金及其化合物在催化剂和能源领域用途非常广泛。
(1)基态Fe2+的核外电子排布式为__。结合电子排布式分析Fe3+比Co3+氧化性弱的原因:__。
(2)BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为__。
②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co3+形成配位键的原子是__。(已知CO32-的结构式为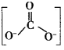 )
)
③NaNT可以![]() (双聚氰胺)为原料制备,双聚氰胺中碳原子杂化轨道类型为__,1mol
(双聚氰胺)为原料制备,双聚氰胺中碳原子杂化轨道类型为__,1mol![]() 中含有σ键的物质的量为__。
中含有σ键的物质的量为__。
④[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为__。
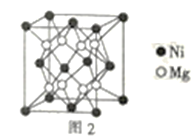
(3)一种新型的功能材料的晶胞结构如图1所示,它的化学式可表示为___。晶胞中离1个Mn原子最近的Ni原子有__个。
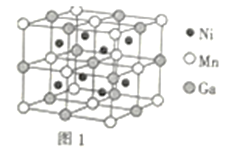
(4)镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图2所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm,则镍镁晶体未储氢时的密度为__(列出计算表达式,NA表示阿伏加德罗常数的数值)gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知723K时,2SO2(g)+O2(g)![]() 2SO3(g)△H=﹣QkJ/mol,在相同条件下,向一密闭容器中通入2mol SO2和1mol O2,达到平衡时放出的热量为Q1kJ;向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时放出的热量为Q2kJ。则Q1、Q2、Q满足的关系是( )
2SO3(g)△H=﹣QkJ/mol,在相同条件下,向一密闭容器中通入2mol SO2和1mol O2,达到平衡时放出的热量为Q1kJ;向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时放出的热量为Q2kJ。则Q1、Q2、Q满足的关系是( )
A.Q2=![]() B.Q2>
B.Q2>![]() C.Q2<Q1<Q D.Q=Q1>Q2
C.Q2<Q1<Q D.Q=Q1>Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.一般沉淀离子浓度小于10-5mol·L-1时,则认为已经沉淀完全
B.反应AgCl+NaBr=AgBr+NaCl能在水溶液中能进行,是因为AgCl比AgBr更难溶于水
C.Al(OH)3(s)![]() Al3+(aq)+3OH-(aq)表示沉淀溶解平衡,Al(OH)3
Al3+(aq)+3OH-(aq)表示沉淀溶解平衡,Al(OH)3![]() Al3++3OH-表示水解平衡
Al3++3OH-表示水解平衡
D.只有反应速率很高的化学反应才能应用于工业生产
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜在自然界中常以多种形态存在,现以孔雀石矿石[成分为Cu2(OH)2CO3、CuFeS2、SiO2、Fe2O3等]为原料生产主产品胆矾和副产品铁红的工艺流程如图:
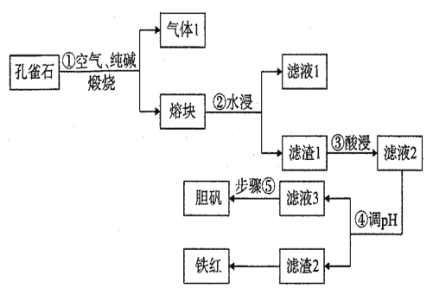
(1)气体1的成分除H2O(g)外,还有CO2、SO2,写出步骤①中发生氧化还原反应的化学方程式为 _______________,若反应生成1mol SO2,则反应中转移的电子数为___________mol。滤液1的主要成分为__________(写化学式)
(2)目前工业生产中步骤③酸浸的百分率为70%,为进一步提高酸浸的百分率可采取的措施有_________________(答出两点)。
(3)步骤④调pH所用试剂为_____________ (写化学式)
(4)常温下滤液3的pH=4,Ksp[Fe(OH) 3]=4×10-38,则滤液3中c(Fe3+)=___________。
(5)步骤⑤操作为_______________________________________________________.。
(6)假设使用孔雀石矿石质量为m kg,步骤③酸浸的百分率为70%,经滤渣2所得铁红的质量为n kg,则:
①铁红的用途之一为________,
②孔雀石矿石中铁元素的含量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。
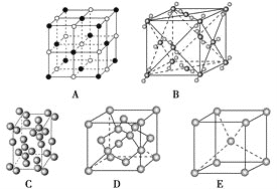
(1)辨别晶胞(请用相应的编号填写)。
①钠晶胞是________;
②碘晶胞是________;
③金刚石晶胞是________;
④干冰晶胞是________;
⑤氯化钠晶胞是________。
(2)与冰的晶体类型相同的是__________。
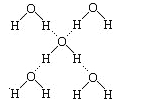
(3)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ·mol-1,除氢键外,水分子间还存在范德华力(11 kJ·mol-1),则冰晶体中氢键的“键能”是________kJ·mol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com