
����Ŀ����������Ȼ������Ҫ�ɷ֣���һ����Ҫ�������Դ�ͻ���ԭ�ϡ�
��1����ú����Ȼ��ʱ�ᷢ�������Ӧ��ͨ������;������CH4��
��֪��C��s��ʮ2H2��g�� ![]() CH4��g�� ��H=��73kJ/mol
CH4��g�� ��H=��73kJ/mol
2CO��g�� ![]() C��s��+CO2��g�� ��H=��171kJ/mol
C��s��+CO2��g�� ��H=��171kJ/mol
CO��g��ʮ3H2��g�� ![]() CH4��g��+H2O��g�� ��H=��203kJ/mol��
CH4��g��+H2O��g�� ��H=��203kJ/mol��
д��CO��g�� ��H2O��g�� ��Ӧ����H 2��g�� ��CO2��g�� ���Ȼ�ѧ����ʽ____________��
��2����Ȼ���к���H2S���ʣ�ij����С���ð�ˮ���յõ�NH4HS��Һ����֪T��k��NH3��H2O�� =1.74��10��5�� k1��H2S�� =1.07��10��7�� k2��H2S�� =1.74��10��13��NH4HS��Һ����������Ũ�ȴ�С��ϵ��ȷ����____________��
A c��NH4+��>c��HS����>c��OH���� >c��H+��
B c��HS���� > c��NH4+��> ��S2���� >c��H+��
C c��NH4+��>c��HS���� >c��H2S�� >c��H+��
D c��HS���� >c��S2���� >c��H+��>c��OH����
��3����ҵ�ϳ���CH4��ˮ������һ������������ȡH2����ԭ��Ϊ�� CH4��g��+H2O��g�� ![]() CO��g��+3H2��g��
CO��g��+3H2��g��
��һ���¶�ʱ�� ��һ�����Ϊ2L�ĺ����ܱ������У� ����1molCH4��1.4molˮ��������������Ӧ�� 5min���ƽ�⣬ ����0.2mol CO�� ��H2��ʾ�÷�Ӧ������Ϊ____________���˷�Ӧ��ƽ�ⳣ��Ϊ____________�����������С�������λ����
������˵������˵���˷�Ӧ�ﵽƽ��״̬����____________��
A ��ϵ��ѹǿ���ٷ����仯
B ����1molCH4��ͬʱ����3molH2
C ����ֵ����ʵ���Ũ�Ȳ��ٸı�
D ��ϵ���ܶȲ��ٷ����仯
E ��Ӧ����V��CH4����V��H2O����u��CO����u��H2��=1��1��1��3
��4���״�ˮ�����������ⷴӦ��CH3OH��g��+H2O��g��=CO2��g��+3H2��g�� ��H=+49kJ/mol��ij�¶��£� ��[n��H2O�� ��n��CH3OH�� ] =1��1��ԭ������������ܱ������У���ʼѹǿΪp1����Ӧ�ﵽƽ��ʱ��ѹǿΪp2����ƽ��ʱ�״���ת����Ϊ____________��
���𰸡�CO(g)+H2O(g)=H2(g)+CO2(g) ��H=41 kJmol1 ac 0.06 molL1min1 0.011 AC ![]()
��������
��C(s)+2H2(g)CH4(g) ��H=73 kJmol1�٣�2CO(g) C(s)+CO2(g) ��H=171 kJmol1�ڣ�CO(g) +3H2(g)CH4(g)+H2O(g) ��H=203 kJmol1�ۣ�������ʽ��+�ڢ۵�CO(g)+H2O(g)=H2(g)+CO2(g)���ʱ������Ӧ�ĸı䡣
�Ƹ��ݵ���ƽ�ⳣ��֪��һˮ�ϰ�����̶ȴ����������̶ȣ�����NH4HS��Һ笠�����ˮ��̶�С��HS��ˮ��̶ȣ���Һ�ʼ��ԣ���c(OH��)> c(H+)����笠����Ӻ���������ˮ��̶ȶ���С�����������ˮ��̶ȴ��������̶ȡ�
�Ǣٸ�������ʽ�����㣻��A����Ӧ��ƽ��֮ǰ����ϵ��ѹǿ��������B������1molCH4ʱһ��ͬʱ����3mol H2��C���ڷ�Ӧ��ƽ��֮ǰ������ֵ����ʵ���Ũ���ڱ䣻D���˷�Ӧ�Ǹ�������������������ķ�Ӧ��E����Ӧ����V(CH4)��V(H2O)��v(CO)��v(H2)=1��1��1��3�������
�Ⱥ��º����£������ѹǿ֮�ȵ��������ʵ���֮�ȣ�����ƽ��ʱ����������ʵ����������ò���������μӷ�Ӧ�״������ʵ�������������״���ת���ʡ�
��C(s)+2H2(g)CH4(g) ��H=73kJmol1�٣�2CO(g) C(s)+CO2(g) ��H=171 kJmol1�ڣ�CO(g) +3H2(g)CH4(g)+H2O(g) ��H=203 kJmol1�ۣ�������ʽ��+�ڢ۵�CO(g)+H2O(g)=H2(g)+CO2(g) ��H=(73 kJmol1)+(171 kJmol1)(203 kJmol1)=41 kJmol1���ʴ�Ϊ��CO(g)+H2O(g)=H2(g)+CO2(g) ��H=41 kJmol1��
(2)���ݵ���ƽ�ⳣ��֪��һˮ�ϰ�����̶ȴ����������̶ȣ�����NH4HS��Һ笠�����ˮ��̶�С��HSˮ��̶�,��Һ�ʼ��ԣ���cOH)>c(H+)����笠����Ӻ���������ˮ��̶ȶ���С����������Ũ�ȴ�С˳����c(NH4+4)>c(HS)>c(OH)>c(H+)�����������ˮ��̶ȴ��������̶ȣ����Ի�����c(NH4+4)>c(HS)>c(OH)>c(H+)����ѡac��
(3)����һ�����Ϊ2L�ĺ����ܱ������У�����1molCH4��1.4molˮ��������������Ӧ��5s���ƽ�⣬����0.2molCO����������ʽ���У�
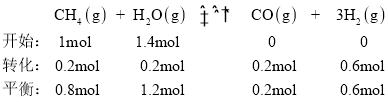
����H2��ʾ�÷�Ӧ������Ϊ![]() ���˷�Ӧ��ƽ�ⳣ��
���˷�Ӧ��ƽ�ⳣ��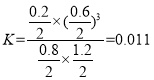 ���ʴ�Ϊ��0.06 molL1min1��0.011��
���ʴ�Ϊ��0.06 molL1min1��0.011��
�ڢ�A. ��Ӧ��ƽ��֮ǰ����ϵ��ѹǿ�������ʵ���ϵѹǿ����ʱ����Ӧ��ƽ�⣬��A��ȷ��B. ����1mol CH4ʱһ��ͬʱ����3mol H2���DZ�Ȼ�Ĺ�ϵ��������Ϊƽ��ı�־����B����C. �ڷ�Ӧ��ƽ��֮ǰ������ֵ����ʵ���Ũ���ڱ䣬�ʵ�����ֵ�Ũ�Ȳ���ʱ����Ӧ��ƽ�⣬��C��ȷ��D. �˷�Ӧ�Ǹ�������������������ķ�Ӧ����������ܶ���=m��V(��)���ܶ�һֱ���䣬�ʲ�����Ϊƽ��ı�־����D����E. ��Ӧ���ʦ�(CH4):��(H2O): ��(CO): ��(H2)=1:1:1:3��������뷴Ӧ�ﲻ��ƽ��û�й�ϵ���ʲ�����Ϊƽ��ı�־����E����ѡAC��
(4)����ʼn(H2O)=n(CH3OH)=1mol�����º����£������ѹǿ֮�ȵ��������ʵ���֮�ȣ�ƽ��ʱ����������ʵ���![]() ��
�� ��
��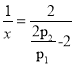 �����
�����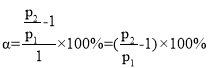 ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�������Դ����������ȡ�봢��������Դ����������о��ȵ㡣
��֪��CH4��g��+H2O��g��=CO��g��+3H2��g����H=206.2 kJ![]()
CH4��g��+CO2��g��=2CO��g��+2H2��g����H=247.4 kJ![]()
2H2S��g��=2H2��g��+S2��g����H=169.8 kJ![]()
�Լ���Ϊԭ����ȡ�����ǹ�ҵ�ϳ��õ����ⷽ����CH4�� H2O��g����Ӧ����CO2��g���� H2��g�����Ȼ�ѧ����ʽΪ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ຣ������Ϊ08�������˻ά��������������Ҫ�ɷ���������ʯ����������ʯ����ɵ���ά״������壬��ʯ��Tremolite���Ļ�ѧ�ɷ�ΪCa2Mg5Si8O22(OH)2�������й�˵������ȷ����
A.��ʯ�Ļ�ѧʽд�����������ʽΪ��2CaO��5MgO��8SiO2��H2O
B.��ʯ�Ļ�ѧʽд�ɹ����ε���ʽΪ��2CaSiO3��5MgSiO3��H2SiO3
C.��ʯ��MgԪ�ص�����������CaԪ������������2��
D.��ʯ�л�������������Al����Mg��Na��K��Mn����Ca��Mg�ȡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D��E��FΪԪ�����ڱ���ԭ���������������ǰ20��Ԫ�أ�A��B��C��D��E�ֱ�λ��ͬһ���ڡ�Aԭ��L������2�ԳɶԵ��ӣ�B��C��D�ĺ�������Ų���ͬ�ļ����ӿ��γ�һ��C3DB6�����Ӿ���X��CE��FAΪ��������ͬ�����Ӿ��塣
��1����д��F���ӵĵ����Ų�ʽ_________��
��2��д��X�Ļ�ѧʽ________��X�Ļ�ѧ����Ϊ______��
��3��д��X�漰���������е�һ����ѧ����ʽ��__________��
��4���Խ���ҵұ��D����DE3������D2A3Ϊԭ�ϵ�ԭ��____________��
��5��F��B���γ����ӻ�����侧���ṹ��ͼ��ʾ��F��B�γɵ����ӻ�����Ļ�ѧʽΪ__________�������ӻ����ᄃ����ܶ�Ϊa g��cm��3�����������________��ֻҪ���г���ʽ����
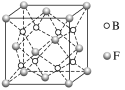
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������Է�������884����һ�ֵ��͵�֬���������ڴ�лʱ�ɷ������·�Ӧ��C57H104O6(s)+80O2(g)��57CO2(g)+52H2O(l)����֪Ҫ����1kg�û�������������Լ200���ÿ����1���ﰴƽ������190 kJ�ƣ����������������ȼ������HԼΪ�� ��
A.3.8��104kJ��mol-1B.��3.8��104kJ��mol-1
C.3.4��104kJ��mol-1D.��3.4��104kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���Ʊ�������茶���[(NH4)3Fe(C2O4)3]�Ĺ����������£�
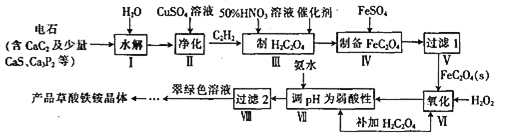
�ش��������⣺
(1)CaC2�ĵ���ʽΪ__________
(2)��������Ҫ�dz�ȥH2S��PH3���������塣�ڳ�PH3ʱ��PH3������ΪH3PO4��CuSO4����ԭΪCu���÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ____________
(3)��������H2C2O4ʱ��Ҫ��������Ļ�ԭ����ΪNO���÷�Ӧ�Ļ�ѧ����ʽΪ______________�������Ũ�ȼ���Ӧ�¶ȶ����˹��ߣ�����Ϊ____________.
(4)������1����Գ�������ϴ�Ӽ������Ƿ�ϴ�Ӹɾ���������____________________
(5)��������VII���Ӳ����Ŀ����______________________.
(6)����VIII����Һ�Ƶò�Ʒ�IJ���Ϊ____________��____________�����ˡ�ϴ�ӡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������εı�����Һ�У�Ag��Ũ��������(����)
A.AgCl(Ksp��1.8��10��10 molL��1)
B.Ag2CO3(Ksp��8.1��10��12 molL��1)
C.Ag2CrO4(Ksp��9.0��10��12 molL��1)
D.AgBr(Ksp��5.0��10��13 molL��1)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ԭ���ڻ�ѧ��ҵ���й㷺Ӧ�á���ͼ��ʾһ�����أ�װ�е��Һa��X��Y������缫�壬ͨ��������ֱ����Դ��������ش��������⣺
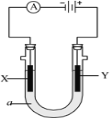
��1����X��Y���Ƕ��Ե缫��a�DZ���NaCl��Һ��ʵ�鿪ʼʱ��ͬʱ�����߸����뼸�η�̪��Һ����
�ٵ�����X���ϵĵ缫��Ӧʽ��___����X�������۲쵽��������___��
��Y�缫�ϵĵ缫��Ӧʽ��___������õ缫��Ӧ����ķ�����___��
��2����Ҫ�õ�ⷽ��������ͭ�����Һaѡ��CuSO4��Һ����
��X�缫�ĵ缫��Ӧʽ��___��
��Y�缫�IJ�����___��
�ۼ�����·����0.04Ħ������ͨ��ʱ����������___�ˡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ 2NO(g)+O2(g)2NO2(g) H<0�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�������ʾ��ͼ��˵����t1ʱ�̴ﵽƽ��״̬���� ( )
a. 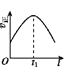 b.
b.  c.
c. 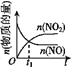 d.
d. 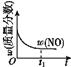
A.abB.bcC.bdD.cd
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com