
【题目】下列叙述正确的是( )
A.一般沉淀离子浓度小于10-5mol·L-1时,则认为已经沉淀完全
B.反应AgCl+NaBr=AgBr+NaCl能在水溶液中能进行,是因为AgCl比AgBr更难溶于水
C.Al(OH)3(s)![]() Al3+(aq)+3OH-(aq)表示沉淀溶解平衡,Al(OH)3
Al3+(aq)+3OH-(aq)表示沉淀溶解平衡,Al(OH)3![]() Al3++3OH-表示水解平衡
Al3++3OH-表示水解平衡
D.只有反应速率很高的化学反应才能应用于工业生产
科目:高中化学 来源: 题型:
【题目】青海昆仑玉被定为08北京奥运会奖牌用玉,昆仑玉主要成分是由“透闪石”和“阳起石”组成的纤维状微晶结合体,透闪石(Tremolite)的化学成份为Ca2Mg5Si8O22(OH)2。下列有关说法不正确的是
A.透闪石的化学式写成氧化物的形式为:2CaO·5MgO·8SiO2·H2O
B.透闪石的化学式写成硅酸盐的形式为:2CaSiO3·5MgSiO3·H2SiO3
C.透闪石中Mg元素的质量分数是Ca元素质量分数的2倍
D.透闪石中还可能有少量的Al代替Mg,Na、K、Mn代替Ca、Mg等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列难溶盐的饱和溶液中,Ag+浓度最大的是( )
A.AgCl(Ksp=1.8×10-10 molL﹣1)
B.Ag2CO3(Ksp=8.1×10-12 molL﹣1)
C.Ag2CrO4(Ksp=9.0×10-12 molL﹣1)
D.AgBr(Ksp=5.0×10-13 molL﹣1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
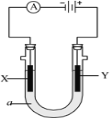
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式是___。在X极附近观察到的现象是___。
②Y电极上的电极反应式是___,检验该电极反应产物的方法是___。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的电极反应式是___。
②Y电极的材料是___。
③假若电路中有0.04摩尔电子通过时,阴极增重___克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酰氯(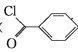 )是制备染料,香料药品和树脂的重要中间体,以光气法制备苯甲酰氯的原理如下(该反应为放热反应):
)是制备染料,香料药品和树脂的重要中间体,以光气法制备苯甲酰氯的原理如下(该反应为放热反应):
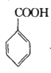 +COCl2
+COCl2![]()
![]() +CO2+HCl
+CO2+HCl
已知物质性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 |
苯甲酸 | 122.1 | 249 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 |
碳酰氯(COCl2) | -188 | 8.2 | 较易溶于苯、甲苯等。遇水迅速水解,生成氯化氢,与氨很快反应,主要生成尿素[CO(NH2)2]和氯化铵等无毒物质 |
苯甲酰氯 | -1 | 197 | 溶于乙醚、氯仿和苯。遇水或乙醇逐渐分解,生成苯甲酸或苯甲酸乙酯和氯化氢 |
三氯甲烷(CHCl3) | -63.5 | 63.1 | 不溶于水,溶于醇、苯。极易挥发,稳定性差,450℃以上发生热分解 |
I.制备碳酰氯
反应原理:2 CHCl3+O2![]() 2HCl+COCl2
2HCl+COCl2
甲. 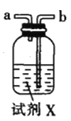 乙.
乙. 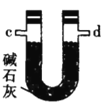 丙.
丙. 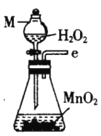 丁.
丁. 戊.
戊. 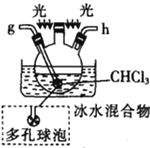
(1)仪器M的名称是____________
(2)按气流由左至右的顺序为___________→c→d→_________→_________→_________→_________→_________.
(3)试剂X是_______________(填名称)。
(4)装置乙中碱石灰的作用是____________。
(5)装置戊中冰水混合物的作用是____________;多孔球泡的作用是________________。
Ⅱ.制备苯甲酰氯(部分夹持装置省略)
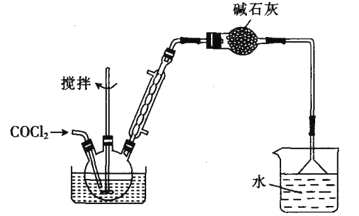
(6)碳酰氯也可以用浓氨水吸收,写出该反应的化学方程式:______________。
若向三颈烧瓶中加入610g苯甲酸,先加热至140~150℃,再通入COCl2,充分反应后,最后产品经减压蒸馏得到562g苯甲酰氯,则苯甲酸的转化率为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H2(g)+ ![]() O2(g)=H2O(g);ΔH1= akJ·mol-1
O2(g)=H2O(g);ΔH1= akJ·mol-1
②2H2(g)+O2(g) = 2H2O(g);ΔH2= b kJ·mol-1 ③ H2(g)+ ![]() O2(g)=H2O(l);ΔH3= c kJ·mol-1
O2(g)=H2O(l);ΔH3= c kJ·mol-1
④2H2(g)+O2(g) = 2H2O(l);ΔH4= d kJ·mol-1,下列关系式中正确的是( )
A.2a=b<0B.b>d>0C.a<c<0D.2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 2NO(g)+O2(g)2NO2(g) H<0,若该反应在绝热、恒容的密闭体系中进行,则下列示意图能说明在t1时刻达到平衡状态的是 ( )
a. 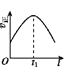 b.
b.  c.
c. 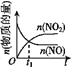 d.
d. 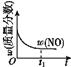
A.abB.bcC.bdD.cd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() (主要指NO和
(主要指NO和![]() )是大气主要污染物之一。有效去除大气中的
)是大气主要污染物之一。有效去除大气中的![]() ,是环境保护的重要课题。
,是环境保护的重要课题。
(1)用稀硝酸吸收![]() ,得到
,得到![]() 和
和![]() 的混合溶液,惰性电极电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:______________________________________。
的混合溶液,惰性电极电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:______________________________________。
(2)在有氧条件下,新型催化剂M能催化![]() 与
与![]() 反应生成
反应生成![]() 。
。
①写出![]() 与
与![]() 反应方程式__________________________________________。
反应方程式__________________________________________。
②将一定比例的![]() 、
、![]() 和
和![]() 的混合气体,匀速通入装有催化剂M的反应器中反应(如图-1所示)
的混合气体,匀速通入装有催化剂M的反应器中反应(如图-1所示)
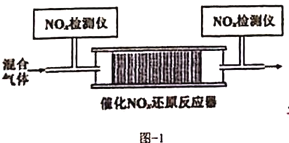

反应相同时间![]() 的去除率随反应温度的变化曲线如图-2所示,在50~150℃范围内随着温度的升高,
的去除率随反应温度的变化曲线如图-2所示,在50~150℃范围内随着温度的升高,![]() 的去除率迅速上升的主要原因是_____________________________,150~380℃范围
的去除率迅速上升的主要原因是_____________________________,150~380℃范围![]() 的去除率上升缓慢的主要原因是_____________________________。当反应温度高于380℃时,
的去除率上升缓慢的主要原因是_____________________________。当反应温度高于380℃时,![]() 的去除率迅速下降的原因可能是:_____________________________;_____________________________。
的去除率迅速下降的原因可能是:_____________________________;_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com