
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
【答案】排除体系中的N2A和DDCxHyOzNm+(![]() )O2
)O2![]() xCO2+
xCO2+![]() H2O+
H2O+![]() N2吸收未反应的O2,保证最终收集的气体是N2量筒内液面与广口瓶中的液面持平视线与凹液面最低处相切ABD
N2吸收未反应的O2,保证最终收集的气体是N2量筒内液面与广口瓶中的液面持平视线与凹液面最低处相切ABD
【解析】
在本实验中,通过测定氨基酸和氧气反应生成产物中二氧化碳、水和氮气的相关数据进行分析。实验的关键是能准确测定相关数据,用浓硫酸吸收水,碱石灰吸收二氧化碳,而且二者的位置不能颠倒,否则碱石灰能吸收水和二氧化碳,最后氮气的体积测定是主要多余的氧气的影响,所以利用加热铜的方式将氧气除去。首先观察装置图,可以看出A中是氨基酸的燃烧,B中吸收生成的水,在C中吸收生成的二氧化碳,D的设计是除掉多余的氧气,E、F的设计目的是通过量气的方式测量氮气的体积,在这个基础上,根据本实验的目的是测定某种氨基酸的分子组成,需要测量的是二氧化碳和水和氮气的量。实验的关键是氮气的量的测定,所以在测量氮气前,将过量的氧气除尽。
(1)装置中的空气含有氮气,影响生成氮气的体积的测定,所以通入一段时间氧气的目的是排除体系中的N2;
(2)氨基酸和氧气反应,以及铜和氧气反应都需要加热,应先点燃D处的酒精灯,消耗未反应的氧气,保证最终收集的气体只有氮气,所以应先点燃D处酒精灯。
(3)氨基酸燃烧生成二氧化碳和水和氮气,方程式为: CxHyOzNm+(![]() )O2
)O2![]() xCO2+
xCO2+![]() H2O+
H2O+![]() N2;
N2;
(4)加热铜可以吸收未反应的O2,保证最终收集的气体是N2 ;
(5)读数时必须保证压强相同,所以注意事项为量筒内液面与广口瓶中的液面持平而且视线与凹液面最低处相切;
(6) 根据该实验原理分析,要测定二氧化碳和水和氮气的数据,再结合氨基酸的相对分子质量确定其分子式。故选ABD。


科目:高中化学 来源: 题型:
【题目】1mol仅含C、H、O三种元素的有机物A在稀硫酸中水解生成1molB和1molC, B分子中N(C)∶N(H)=4∶5,135<Mr(B)<140;C与B分子中碳原子数相同,且Mr(B)=Mr(C)+2
(1)C的分子式为_____________________,
(2)B的分子具有高度对称性,苯环上的一氯取代物只有一种。B能与金属Na反应但不能与NaOH反应。写出B的结构简式_________________________;
(3)C有多种同分异构体,其中属于芳香族的酯类的同分异构体有_____________种;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中FeCl3的水解反应已达平衡:FeCl3+3H2O![]() Fe(OH)3+3HCl,若要使FeCl3的水解程度增大,应该采用的方法是
Fe(OH)3+3HCl,若要使FeCl3的水解程度增大,应该采用的方法是
A. 加入NaHCO3B. 加入AgNO3固体
C. 加入FeCl3固体D. 降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生活中或实验中常见的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑。
(2)实验原理:电极(______、______)、________、________、稀硫酸、耳机(或者电流计)。(请在空格中填写所缺的实验用品)
(3)实验装置(如图)。
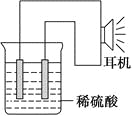
(4)原电池设计及注意的问题:
①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓……”的声音。其原因是:在原电池中,由化学能转化为________,在耳机中又由________转化为声音这种能量。
②如果将装置中的耳机改为电流计,则铁钉应该接电流计的________极,电极反应是_____________________________,发生了________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)下列反应中,属于放热反应的_________,属于吸热反应的是__________填序号)
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的炭 ⑤食物因氧化而腐败 ⑥Ba(OH)2·8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应
(2)断开1 mol H—H键、1 mol N—H键、1 mol N![]() N分别需要吸收能量为436 kJ、391 k、946kJ,则1 mol H2与足量N2反应生成NH3需__________(填“吸收”或“放出”)能量______kJ。(认为反应进行到底)。(小数点后保留两位数字)
N分别需要吸收能量为436 kJ、391 k、946kJ,则1 mol H2与足量N2反应生成NH3需__________(填“吸收”或“放出”)能量______kJ。(认为反应进行到底)。(小数点后保留两位数字)
(3)X、Y两种前20号主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,且X、Y两元素不在相邻的两个周期,则XY2的电子式为:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是( )
A.4.6gNa完全转化成Na2O和Na2O2的混合物,生成物中阴离子总数为0.1NA
B.标准状况下,22.4L丙烷所含共用电子对数为8NA
C.标准状况下,2.24LCl2溶于水,转移的电子数目为0.1NA
D.常温下,1L0.1mol·L-1NH4NO3溶液中含有的NH4+数是0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家借助自主研制的新型钨钴合金催化剂攻克了单壁碳纳米管结构的可控制备难题。
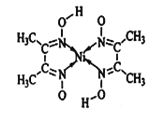
(1)基态钴原子的核外未成对电子数为__________。单壁碳纳米管可看作石墨烯沿一定方向卷曲而成的空心圆柱体,其结构如图所示,其中碳原子的杂化方式为_______。
(2)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化,已知甲醛各原子均满足稳定结构,甲醛分子属______分子(选填“极性”“非极性”),其分子的空间构型为_____。新制备的Cu(OH)2可将乙醛(CH3CHO)氧化为乙酸,而自身还原成Cu2O,乙酸的沸点明显高于乙醛,其主要原因是______。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有______个铜原子。金属Cu为________堆积,配位数为_______。
(3)橙红色晶体羰基钴的熔点为52℃,分子式为Co2(CO)8,是一种重要的配合物,可溶于多数有机溶剂。该晶体属于______晶体,三种元素电负性由大到小的顺序为(填元素符号)_____。配体CO的任意一种等电子体的电子式:_____。配体CO中与Co形成配位键的原子是C而不是O的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知①R—Br![]() R—OH(R表示烃基);
R—OH(R表示烃基);
②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著的影响;
③![]()
④![]()
以下是用苯作为原料制备一系列化合物的转化关系图:
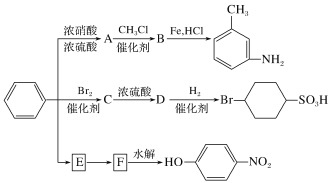
(1)A是一种密度比水___(填“大”或“小”)的无色液体,苯转化为A的化学方程式是________________。
(2)图中苯转化为E;E转化为F省略了条件,请写出E、F的结构简式:
E______________________________,F______________________________。
(3)在“苯![]() C
C![]() D
D![]()
![]() ”的转化过程中,属于取代反应的是___(填序号,下同),属于加成反应的是_____。
”的转化过程中,属于取代反应的是___(填序号,下同),属于加成反应的是_____。
(4)B分子中苯环上的任意两个氢被溴原子取代后,得到的二溴代物有________种同分异构体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,NaCN溶液中CN-、HCN浓度所占分数(![]() )随pH变化的关系如图甲所示,其中a点的坐标为(9.5,0.5)。向10mL0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,其pH变化曲线如图乙所示。下列溶液中的关系中一定正确的
)随pH变化的关系如图甲所示,其中a点的坐标为(9.5,0.5)。向10mL0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,其pH变化曲线如图乙所示。下列溶液中的关系中一定正确的
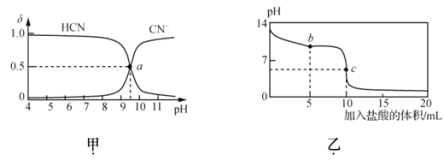
A.图甲中pH=7的溶液:c(Cl-)=c(HCN)
B.常温下,NaCN的水解平衡常数:Kh(NaCN)=10-4.5mol/L
C.图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D.图乙中c点的溶液:c(Na+)+ c(H+)= c(HCN)+ c(OH-)+ c(CN-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com