
【题目】我国科学家借助自主研制的新型钨钴合金催化剂攻克了单壁碳纳米管结构的可控制备难题。
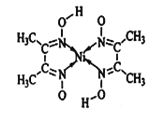
(1)基态钴原子的核外未成对电子数为__________。单壁碳纳米管可看作石墨烯沿一定方向卷曲而成的空心圆柱体,其结构如图所示,其中碳原子的杂化方式为_______。
(2)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化,已知甲醛各原子均满足稳定结构,甲醛分子属______分子(选填“极性”“非极性”),其分子的空间构型为_____。新制备的Cu(OH)2可将乙醛(CH3CHO)氧化为乙酸,而自身还原成Cu2O,乙酸的沸点明显高于乙醛,其主要原因是______。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有______个铜原子。金属Cu为________堆积,配位数为_______。
(3)橙红色晶体羰基钴的熔点为52℃,分子式为Co2(CO)8,是一种重要的配合物,可溶于多数有机溶剂。该晶体属于______晶体,三种元素电负性由大到小的顺序为(填元素符号)_____。配体CO的任意一种等电子体的电子式:_____。配体CO中与Co形成配位键的原子是C而不是O的原因是________。
【答案】3 sp2和sp3 极性 平面三角形 乙酸分子间形成氢键,作用力大,熔沸点高 16 面心立方最密堆积 12 分子 O>C>Co ![]() C原子半径大于O,电负性小,对孤电子对的吸引较弱,更容易形成配位键
C原子半径大于O,电负性小,对孤电子对的吸引较弱,更容易形成配位键
【解析】
(1)Co元素是27号元素,核外电子排布式为:[Ar]3d74s2;碳原子形成3个C-C键,没有孤电子对,杂化轨道为3,还有饱和C原子,形成3个C-H键和一个C-C键;
(2)甲醛分子中C原子形成3个σ键,没有孤电子对,价层电子对数=3+0=3,据此判断空间构型,正负电荷重心重合属于非极性分子,否则属于极性分子;乙酸分子间会形成氢键,增加了分子之间的吸引力;先用均摊方法计算晶胞中含有的O原子数,然后根据化学式确定其中含有的Cu原子数目;金属Cu为面心立方最密堆积,配位数是12;
(3)熔点低,溶于有机溶剂,符合分子晶体的性质;同周期主族元素自左而右电负性增大,一般非金属性越强电负性越大;CO与氮气分子互为等电子体,C、O均有孤对电子,电负性越大越不易给出电子。
(1)Co元素是27号元素,核外电子排布式为:[Ar]3d74s2,3d上有3个成对电子;根据单壁碳纳米管结构可知:碳原子形成3个C-C键,没有孤电子对,杂化轨道为3,碳原子杂化方式为:sp2;除此之外还有饱和C原子,其杂化方式为sp3杂化;
(2)甲醛分子中C原子形成3个σ键,没有孤电子对,价层电子对数=3+0=3,空间构型为平面三角形,正负电荷重心不重合,属于极性分子;新制备的Cu(OH)2可将乙醛(CH3CHO)氧化为乙酸,而自身还原成Cu2O,乙酸的沸点明显高于乙醛,主要原因是乙酸分子间形成氢键,使分子之间的作用力增大,导致克服分子间作用力使物质熔化、气化消耗的能量多,因此物质的熔沸点高。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中含义的O原子数为8×![]() +6×
+6×![]() +4=8,由于Cu2O中Cu:O=2:1,所以该晶胞中含有的Cu原子数目为2×8=16;金属Cu为面心立方最密堆积堆积,配位数为
+4=8,由于Cu2O中Cu:O=2:1,所以该晶胞中含有的Cu原子数目为2×8=16;金属Cu为面心立方最密堆积堆积,配位数为![]() =12。
=12。
(3)羰基钴熔点低,溶于有机溶剂,属于分子晶体;同一周期的主族元素自左而右电负性增大,一般非金属性越强电负性越大,所以元素的电负性:O>C>Co;CO与N2分子互为等电子体,N2的电子式为![]() ;CO中C、O原子均有孤对电子,C原子半径比O大,电负性小,对孤对电子吸引较弱,更容易形成配位键。
;CO中C、O原子均有孤对电子,C原子半径比O大,电负性小,对孤对电子吸引较弱,更容易形成配位键。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】下图所示2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是
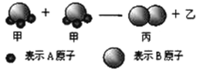
A.1个乙分子中含有2个A原子
B.该反应类型是分解反应
C.相对分子质量:Mr(甲)=Mr(乙)+Mr(丙)
D.该反应一定属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2FeO4在酸性或中性溶液中能快速产生O2,在碱性溶液中较稳定。如图是制备高铁酸钾的一种装置,制取实验完成后,取C中紫色溶液,加入稀盐酸,产生气体。下列说法不正确的是( )
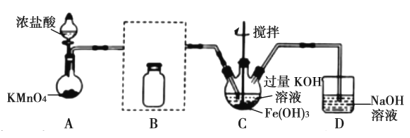
A.B瓶应盛放饱和食盐水除去混有的HCl
B.C瓶中KOH过量更有利于高铁酸钾的生成
C.加盐酸产生气体可说明氧化性:K2FeO4>Cl2
D.高铁酸钾是集氧化、吸附、絮凝等特点为一体的优良的水处理剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层的电子数之和。
(1)C2D电子式为__________,D原子的质子数和中子数相等,D的原子组成符号为______。
(2)用电子式表示A、B两元素形成AB2的过程_______________________________。
(3)E和A的最高价氧化物反应的化学方程式_________________________________。
(4)足量的AB2与C的最高价氧化物对应水化物反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3和NaHCO3性质的出较中,正确的是
A. 等浓度的溶液中滴入稀盐酸,放出气体的快慢Na2CO3<NaHCO3
B. 热稳定性Na2CO3<NaHCO3
C. 常温时水溶性Na2CO3<NaHCO3
D. 可以用澄清石灰水鉴别Na2CO3和NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按系统命名法填写下列有机物的名称:
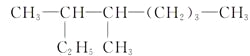 的名称是____________________。
的名称是____________________。
(2)2,6-二甲基-4-乙基辛烷的结构简式是______________,1 mol该烃完全燃烧需消耗氧气________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次氯酸钾是―种白色粉末,极易溶于冷水,遇热水则分解,在空气中极不稳定,受热后迅速自行分解。工业上生产次氯酸押的流程如下:
![]()
下列说法正确的是
A. 步骤Ⅰ、Ⅱ发生的反应均为非氧化还原反应
B. 步骤Ⅱ采取的方法是加入足量水以制得Ca(OH)2溶液
C. 步骤Ⅲ氧化时,氯气是氧化剂,Ca(OH)2是还原剂
D. 步骤Ⅵ的操作包括蒸发浓缩,冷却结晶、在空气中晾干
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是一种重要的氧化物,可用于生产三氧化硫、硫酸、亚硫酸盐、硫代硫酸盐,也可用作熏蒸剂、防腐剂、消毒剂、还原剂等。
(1)SO2性质多变,若将SO2气体通入氢硫酸中,能看到的现象为:__________,该反应中SO2表现出______性;若将SO2气体通入酸性高锰酸钾溶液中,离子反应方程式为_________,该反应中SO2表现出__________性。
(2)SO2有毒,且能形成酸雨,是大气主要污染物之一。石灰-石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收原理:①SO2+Ca(OH)2=CaSO3↓+H2O②2CaSO3+O2+4H2O=2CaSO4·2H2O碱法的吸收原理:将含SO2的尾气通入足量的烧碱溶液中,请写出对应的化学反应方程式__________;
已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
余石灰-石膏法相比,碱法的优点是吸收快、效率高,缺点是__________;
(3)在石灰-石膏法和碱法的基础上,设计了双碱法,能实现物料循环利用。

上述方法中,实现循环利用的物质是__________,请用化学方程式表示在Na2SO3溶液中加入CaO后的反应原理__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com