
【题目】SO2是一种重要的氧化物,可用于生产三氧化硫、硫酸、亚硫酸盐、硫代硫酸盐,也可用作熏蒸剂、防腐剂、消毒剂、还原剂等。
(1)SO2性质多变,若将SO2气体通入氢硫酸中,能看到的现象为:__________,该反应中SO2表现出______性;若将SO2气体通入酸性高锰酸钾溶液中,离子反应方程式为_________,该反应中SO2表现出__________性。
(2)SO2有毒,且能形成酸雨,是大气主要污染物之一。石灰-石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收原理:①SO2+Ca(OH)2=CaSO3↓+H2O②2CaSO3+O2+4H2O=2CaSO4·2H2O碱法的吸收原理:将含SO2的尾气通入足量的烧碱溶液中,请写出对应的化学反应方程式__________;
已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
余石灰-石膏法相比,碱法的优点是吸收快、效率高,缺点是__________;
(3)在石灰-石膏法和碱法的基础上,设计了双碱法,能实现物料循环利用。

上述方法中,实现循环利用的物质是__________,请用化学方程式表示在Na2SO3溶液中加入CaO后的反应原理__________。
【答案】溶液中生成黄色沉淀 氧化性 2MnO4-+5SO2+2H2O=5SO42-+2Mn2++4H+ 还原性 SO2+2NaOH=Na2SO3+H2O 成本较高 NaOH CaO+H2O=Ca(OH)2 Ca(OH)2+Na2SO3=CaSO3↓+2NaOH
【解析】
(1)将SO2气体通入氢硫酸中,发生反应SO2+2H2S=3S↓+2H2O;将SO2气体通入酸性高锰酸钾溶液中,发生反应:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
(2)二氧化硫和氢氧化钠的反应方程式为:2NaOH+SO2=Na2SO3+H2O,参照价格表,NaOH成本高;
(3)向Na2SO3溶液中加入CaO后,生成NaOH,故NaOH为循环利用的物质;CaO加入溶液中会先和水反应,即CaO+H2O=Ca(OH)2,生成的Ca(OH)2再和Na2SO3溶液反应,据此答题。
(1)二氧化硫具有弱氧化性,将SO2气体通入氢硫酸中,发生反应SO2+2H2S=3S↓+2H2O,
看到的现象为溶液中生成黄色沉淀,二氧化硫中S化合价由+4价→0价,化合价降低的反应物作氧化剂,体现氧化性;将SO2气体通入酸性高锰酸钾溶液中,高锰酸钾具有强氧化性,将二氧化硫溶于水后生成的亚硫酸氧化为硫酸,二氧化硫遇到强氧化剂时体现还原性,将MnO4-还原为Mn2+,S元素的化合价升高2价,锰元素的化合价降低5价,则高锰酸根系数为2,二氧化硫系数为5,根据原子守恒,硫酸根系数为5,Mn2+系数为2,根据电荷守恒,右侧补4个氢原子,最终根据H原子守恒,左侧补2个水,即方程式为:
5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,二氧化硫中S元素的化合价由+4价→+6价,化合价升高的反应物作还原剂,体现还原性,故答案为:溶液中生成黄色沉淀,氧化性,2MnO4-+5SO2+2H2O=5SO42-+2Mn2++4H+,还原性。
(2)二氧化硫作为酸性氧化物,可以和氢氧化钠反应盐和水,参照二氧化碳和氢氧化钠反应的方程式,写出二氧化硫和氢氧化钠的反应方程式为:2NaOH+SO2=Na2SO3+H2O,由于石灰的碱性比氢氧化钠弱,吸收SO2的速率慢、效率低,但吸收成本比氢氧化钠低的多,故答案为:SO2+2NaOH=Na2SO3+H2O,成本较高。
(3)从流程图中可以看出,向Na2SO3溶液中加入CaO后,生成NaOH,生成的NaOH可以作为二氧化硫的吸收剂,故NaOH为循环利用的物质;CaO加入溶液中会先和水反应,即CaO+H2O=Ca(OH)2,生成的Ca(OH)2再和Na2SO3溶液反应,根据流程图,反应物之一为NaOH,再根据复分解反应原理,另一生成物为CaSO3,故反应方程式为:Ca(OH)2+Na2SO3=CaSO3↓+2NaOH,故答案为:NaOH,CaO+H2O=Ca(OH)2、Ca(OH)2+Na2SO3=CaSO3↓+2NaOH。


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】用某废催化剂(主要成分Al2O3、K2O、少量CoO、SiO2等)来制取明矾的工艺流程如下图所示,回答下列问题:
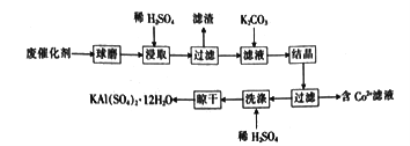
(1)废催化剂在浸取前进行球磨的主要目的是________________________________________。
(2)浸取时Al2O3溶解的化学方程式为________________________________________;
(3)滤渣的主要成分是_________________ (填化学式)。
(4)实验测得K2CO3的加入量与KA1(SO4)2·12H2O产率及纯度关系如下表所示:
编号 | 1 | 2 | 3 | 4 |
K2CO3加入量/g | 2 | 4 | 6 | 8 |
产品质量/g | 3.3 | 5.7 | 4.6 | 4.5 |
明矾纯度/g | 99.1 | 98.2 | 91.4 | 84.9 |
当K2CO3的加入量超过4 g后,晶体的质量减少且纯度降低,其原因是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Cu与CuO的混合物20.8g加到50mL 18.4molL﹣1浓H2SO4中,加热充分反应至固体物质完全溶解,冷却后将混合液稀释至1000mL,测得c(Cu2+)=0.3molL﹣1。(以上过程中硫酸始终是浓硫酸,不考虑气体在水中的溶解)试计算:
(1)反应过程中放出的气体在标准状况下的体积为________L。
(2)溶解稀释后,氢离子的浓度为_________molL﹣1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了如下装置制取和验证SO2的性质。

请回答:
(1)写出图中仪器的名称:a___________,b___________。
(2)棉球中NaOH溶液的作用是______________________。
(3)为了验证SO2是酸性氧化物,洗气瓶②中可选择的试剂是_____________________。
A.紫色石蕊试液 B.无色酚酞试液 C.澄清石灰水 D.碘水
(4)下列说法正确的是____________。
A.实验开始时,只需打开分液漏斗的旋塞,即可使液体顺利滴下
B.先向装置中加入试剂(药品),再进行气密性检查
C.实验开始后,洗气瓶①和③只溶液均褪色,两者均可证明SO2具有漂白性
D.实验开始后,洗气瓶④中可观察到白色沉淀产生,该现象可说明SO2具有还原性
(5)洗气瓶④中发生反应的离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为了探究钠与CO2的反应,利用如图装置进行实验。(已知PdCl2能被CO还原得到黑色的Pd)
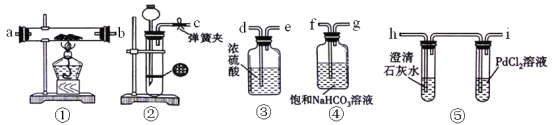
(1)请将上图各装置连接完整(填写装置中序号) → → → → 。
(2)若用稀盐酸与CaCO3反应制备CO2,在加稀盐酸时,发现CaCO3与稀盐酸不能接触,而稀盐酸又不够了,为使反应能顺利进行,可向装置②长颈漏斗中加入的试剂是 。
A.CCl4 B.H2SO4溶液 C.硝酸钠溶液 D.植物油
(3)检查装置②的气密性,方法是 。
装好药品后,点燃酒精灯之前应进行的操作是打开弹簧夹,让CO2充满整个装置,当观察到 时再点燃酒精灯。装置④的作用 。
(4)通入CO2的量不同可能会导致生成的产物不同。假如反应过程中有下列两种情况,按要求分别写出两种情况时的化学方程式。
I.当装置⑤PdCl2溶液中观察到有黑色沉淀产生,装置①中固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体,写出此情况时钠与CO2反应的化学方程式 。
II.当装置①中钠的质量为0.23g时,充分反应后,将装置①中的固体加入到足量稀盐酸中,产生112mL的CO2气体(标况下测定),装置⑤PdCl2溶液中没有观察到黑色沉淀产生,写出此情况时钠与CO2反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胰蛋白酶作用于一定量的某种物质(底物),温度保持37 ℃,pH保持在最适值,生成物量与反应时间关系如下图。请回答下列问题。

(1)该酶作用的底物是 。
(2)在140 min后,曲线变成水平,这是因为
________________________________________________________________________。
(3)若增加胰蛋白酶浓度,其他条件不变,请在原图上画出生成物量变化的示意曲线。
(4)若胰蛋白酶浓度和其他条件不变,反应液pH由2逐渐升高到10,则酶催化反应的速率将________,原因是____________________________________。
(5)下图中能正确表示胰蛋白酶对底物的分解速率和温度关系的是( )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能在无色溶液中大量共存的一组离子是( )
A.NH4+、SO42-、OH-、K+B.Fe3+、NO3-、Cl-、H+
C.K+、HCO3-、Cl-、H+D.H+、Na+、Cl-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com