
【题目】镁是一种重要的金属资源,在各领域都具有重要的作用。
(1)皮江法炼镁是我国生产镁的重要方法,其实质是在高温和真空条件下,有氧化钙存在时,通过硅还原氧化镁生成镁蒸气,与反应生成的固体硅酸二钙(2CaO·SiO2)相互分离,并经冷凝得到结晶镁。写出该反应的化学反应方程式 。
电解槽中先得到的是镁的蒸气,镁蒸气可以在下列 (填编号)气体氛围中冷却。
A.空气 B.氮气 C.水蒸气 D.氢气
(2)目前发达国家80%的镁来自于电解熔融氯化镁。电解原料无水氯化镁可由海水制备。主要有以下步骤:①在干燥的HCl气流中加热脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩冷却结晶。
其步骤先后顺序是_____________________(步骤可重复使用);在干燥的HCl气流中加热时,能得到无水MgCl2,其原因是______________________。
(3)已知某温度下Mg(OH)2的Ksp=6.4×l012,当溶液中c(Mg2+)≤1.0×105mol·L1可视为沉淀完全,则此温度下应保持溶液中c(OH-)≥_______________mol·L1。
(4)在Mg(OH)2悬浊液中滴入饱和NH4Cl溶液,溶液变澄清。反应原因可能有两个:一是NH4+水解产生H+,H+再与Mg(OH)2反应;二是_____________________(用离子方程式表示)。要验证谁是Mg(OH)2溶解的主要原因,可选取________代替NH4Cl溶液作对照实验。
A.NH4NO3 B.(NH4)2SO4 C.CH3COONH4 D.NH4HCO3
(5)镁电池是近年来科学技术研究的热点之一,下图为Mg—NaClO燃料电池结构示意图。其工作时Mg作 (填“X”或“Y”)电极,正极的电极反应式: 。

【答案】
(1)2MgO+Si+2CaO![]() 2CaO·SiO2+2Mg↑(2分) D(1分)
2CaO·SiO2+2Mg↑(2分) D(1分)
(2)②④③⑤④①(2分) 营造酸性氛围抑制Mg2+的水解并及时带走水蒸气(2分)
(3)8×10-4 (2分)
(4)2NH4+ +Mg(OH)2 =2 NH3H2O + Mg2+(2分) C(1分)
(5)Y(1分) ClO- + 2e- + H2O = Cl- +2OH-(2分)
【解析】
试题分析:
(1)皮江法炼镁是在高温和真空条件下,有氧化钙存在时,通过硅还原氧化镁生成镁蒸气,并生成的固体硅酸二钙(2CaO·SiO2)。由此该反应的化学反应方程式为2MgO+Si+2CaO![]() 2CaO·SiO2+ 2Mg↑。电解槽中得到的镁蒸气可以在氢气氛围中冷却,因其他物质均能与镁反应,故选D。
2CaO·SiO2+ 2Mg↑。电解槽中得到的镁蒸气可以在氢气氛围中冷却,因其他物质均能与镁反应,故选D。
(2)海水中Mg以镁离子形式存在,所以先加入熟石灰,使其转化为氢氧化镁沉淀、过滤后加入稀盐酸,转化为氯化镁溶液,蒸发浓缩结晶,不能将溶液蒸干,因为氯化镁水解生成氢氧化镁和氯化氢,加热促进水解,所以待溶液中出现大量固体时,停止加热,冷却后再过滤得氯化镁晶体,最后在干燥的HCl气流中脱水干燥得氯化镁固体,所以步骤先后顺序是②④③⑤④①;因为氯化镁水解生成氢氧化镁和氯化氢,加热促进水解,所以为防止水解,在HCl气流中加热晶体。
(3)某温度下Mg(OH)2的Ksp=6.4×l012,当溶液中c(Mg2+)≤1.0×105mol·L1可视为沉淀完全,则Ksp=c(Mg2+)×c2 (OH-),所以c(OH-)2≥6.4×l012/1.0×105mol·L1=64×l08,c(OH-)≥8×10-4mol/L。
(4)饱和NH4Cl溶液滴入少量的Mg(OH)2悬浊液中,看到的现象是白色沉淀逐渐溶解,溶液变澄清;可能的原因是因为氢氧化镁的悬浊液中存在溶解平衡,氯化铵溶液水解呈酸性,酸与氢氧化镁发生中和反应而使其溶解;或者铵根离子与氢氧化镁溶解产生的氢氧根离子结合为一水合氨,使氢氧化镁溶解平衡中的氢氧根离子浓度减小,平衡正向移动,沉淀溶解,离子方程式是2NH4+ +Mg(OH)2 =2 NH3H2O + Mg2+;要验证谁是Mg(OH)2溶解的主要原因,选择含有铵根离子且溶液呈中性的盐,A、B溶液均呈酸性,与氯化铵的效果相同,D为碱性不能选,而醋酸铵溶液呈中性,加入醋酸铵,若沉淀仍溶解,则是铵根离子的作用,所以答案选C。
(5)由图中OH—向负极移动,那么Y为负极,故镁作Y电极;原电池中,ClO- 在正极发生还原反应,与水结合生成氯离子和氢氧根离子,ClO- + 2e- + H2O = Cl- +2OH-。


科目:高中化学 来源: 题型:
【题目】[化学—选修3物质结构与性质]
铁氧体是一种磁性材料,具有广泛的应用。
(1)基态铁原子的核外电子排布为[Ar] 。
(2)工业制备铁氧体使用水解法,制备时常加入尿素[CO(NH2)2]、醋酸钠等碱性物质。尿素分子中四种不同元素的电负性由大至小的顺序是 ;醋酸钠中碳原子的杂化类型是 。
(3)工业制备铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱。比较下表中氨(NH3)、联氨(N2H4)的熔、沸点,解释其高低的主要原因 。

(4)上图是从铁氧体离子晶体Fe3O4中,取出的能体现其晶体结构的一个立方体,则晶体中的氧离子是否构成了面心立方最密堆积 (填“是”或“否”),该立方体是不是Fe3O4的晶胞 (填“是”或“否”),立方体中三价铁离子处于氧离子围成的 空隙(填空间结构)。
(5)解释Fe3O4晶体能导电的原因 ,根据上图计算晶体的密度 gcm3。(图中a=0.42nm,计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A是石油裂解气的主要成分,A的产量通常来衡量一个国家的石油化工水平;它有如图所示的转化关系。E是具有香味的有机物,F是高分子化合物。
写出下列反应的化学方程式及反应类型:

①_________;反应类型:_____;
②_________;反应类型:_____;
④_________;反应类型:_____;
⑤_________;反应类型:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,可逆反应mA(g)+nB(g)![]() pC(g)的平衡常数为K,下列对K的说法正确的是( )
pC(g)的平衡常数为K,下列对K的说法正确的是( )
A. 如果m+n=p,则K=1 B. 若缩小反应器的容积,能使平衡正向移动,则K增大
C. 温度越高,K一定越大 D. K值越大,表明该反应越有利于C的生成,反应物的转化率越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与化学概念有关的说法正确的是( )
A. 化合反应均为氧化还原反应
B. 金属氧化物均为碱性氧化物
C. 烧碱、纯碱、熟石灰都是碱
D. BaSO4、NaOH、HNO3都是强电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是( )
A.氧化还原反应的本质是元素化合价发生了变化
B.含化合价升高元素的反应物被氧化
C.得到电子的物质被氧化
D.氧化还原反应中,氧化剂和还原剂一定是两种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年,科学家们发明了一种能够给电子设备提供动力的生物燃料电池.该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中.由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示.下列说法正确的是

A. 左边为该电池的负极
B. 该电池可在高温环境下使用
C. 该电池负极反应为:H2-2e-=2H+
D. 该电池正极反应为O2+4e-=2O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A—表示乳酸根离子)。下列说法正确的是( )
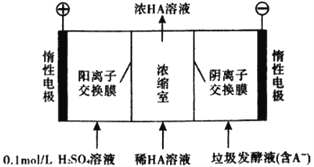
A. 通电后,阳极附近pH增大
B. 电子从负极经电解质溶液回到正极
C. 通电后,A—通过阴离子交换膜从阴极进入浓缩室
D. 当电路中通过2 mol电子的电量时,会有1 mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜版画的一种制版方法。以沥青涂于薄铜板表面作防腐膜,用刀刻去防腐膜作画,然后放在FeCl3腐蚀液中。刮去膜之处被腐蚀,形成凹线。印刷时凹线可储油墨,在铜版机纸压制下油墨吸于纸上,形成典雅、庄重的铜版画。

(1)写出FeCl3腐蚀铜板的离子方程式___________________
(2)下列措施可以加快铜板的腐蚀速率的有____________(填编号)
A. 加热 B. 加氯化铜 C. 加少量碳粉 D. 加盐酸
(3)通常不采用加快腐蚀速率的原因是_________________
(4)除去沥青防腐膜后版即形成。可用________除去防腐膜(填编号)
A. 饱和Na2CO3溶液 B. 煤油 C. 酸液 D.碱液
(5)实验室用固体氯化铁配置FeCl3溶液的简单操作是_____________
(6)腐蚀后的废液(酸性)中加入NaNO3,产生NO气体,写出发生反应的离子方程式,并注明电子转移的方向和数目:__________________________
(7)要验证腐蚀后的废液中含有Fe3+,可在溶液中加入试剂_________,现象_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com