
(10分)如图是用于简单有机化合物的制备、分离、性质比较等的常见简易装置。请
根据该装置回答下列问题:

(1)若用乙醇与乙酸反应制取乙酸乙酯,则烧瓶A
中加入的试剂在混合时的操作方法是___________,反
应的化学方程式为___________ ,试管B中应
加入___________ 。虚线框中的导管除用于导气
外,还兼有___________ 作用。
(2)若用该装置分离乙酸和1-丙醇,则在烧瓶A
中除加入1-丙醇与乙酸外,还应先加入适量的试剂
___________,加热到一定温度,试管B中收集到的是(填写化学式)___________。冷却后,再向烧瓶中加入试剂___________再加热到一定温度,试管B中收集到的是___________(填写化学式)。
若用该装置(不用加热)证明酸性:醋酸>碳酸>苯酚,则在烧瓶A中加入___________ ,试管B中应加入___________。
(1)先加入一定量的乙醇,然后边摇动烧瓶边加入慢慢加入一定量的浓硫酸和乙酸;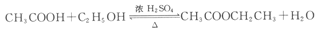 饱和碳酸钠溶液 冷凝(2)生石灰 CH3CH2OH 浓硫酸 CH3COOH;(3)碳酸钠和醋酸 苯酚钠
饱和碳酸钠溶液 冷凝(2)生石灰 CH3CH2OH 浓硫酸 CH3COOH;(3)碳酸钠和醋酸 苯酚钠
【解析】
试题分析:(1)制取乙酸乙酯的试剂是乙酸和乙醇,还需要加入浓硫酸做催化剂,混合试剂时要最后加入浓硫酸,并且还要不断搅拌,因为浓硫酸溶于水时要放出大量的热,要使热量及时散失;试管B要用饱和碳酸钠溶液,因为碳酸钠溶液可以和乙酸反应,可以溶解乙醇,乙酸乙酯在饱和碳酸钠溶液中的溶解度减小;长导气管能达到冷凝乙酸乙酯的目的;;(2)因为乙酸和1-丙醇的沸点差距较小,不能采用直接蒸馏的办法,故需加入氧化钙,先把乙酸转化成离子化合物乙酸钙,蒸馏时出来的只有乙醇,再加入酸,把乙酸钙转化成乙酸,蒸馏时出来的就是乙酸了;(3)根据强酸制弱酸的原理,要证明醋酸大于碳酸,需要醋酸制出碳酸,故可以通过醋酸和碳酸反应生成碳酸,碳酸不稳定,分解成二氧化碳和水证明,要证明碳酸大于苯酚需将二氧化碳通入苯酚钠溶液中,碳酸制出苯酚来证明。
考点:


 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源:2013-2014河南省濮阳市高三第二次模拟考试理综化学试卷(解析版) 题型:推断题
(14分)锌锰废电池可用于生产硫酸锌及碳酸锰,其工艺流程分为预处理、硫酸锌生产线、碳酸锰生产线三部分。其中生产碳酸锰的工艺流程如下:
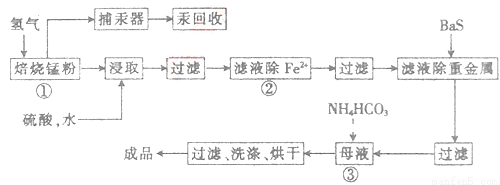
请回答下列问题:
(1)锌锰废电池的回收工艺中,从循环生产角度考虑,上述氢气的来源可以是________。
(2)原料锰粉粗品的主要成分为MnO2和碳,焙烧时一部分MnO2被还原,另一部
分被碳还原,MnO2被还原为一氧化锰。已知:

写出C(s)被MnO2(s)氧化为CO(g)的热化学方程式:________。
(3)50-55 时,向MnSO4的母液中加入足量NH4HCO3,反应的化学方程式为MnSO4+
时,向MnSO4的母液中加入足量NH4HCO3,反应的化学方程式为MnSO4+

(4)已知三种离子沉淀时的pH范围:Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6。步骤②中除去的方法是先在酸性条件下加入_________,将Fe2+氧化为Fe3+,然后再将pH调至_______,使Fe3+沉淀完全。
(5)产品MnCO3溶于硫酸得硫酸锰溶液,电解该溶液可得二氧化锰,写出阳极的电极反应式:_____________。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省洛阳市高三年级第三次考试理综化学试卷(解析版) 题型:简答题
(15分)(1)碳、氮、氧的第一电离能大小顺序为 ,氧原子电子排布式为 。
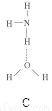
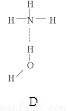
(2)氨分子氮原子杂化类型 ,氨水中四种氢键哪一种是主要的 ,规律是什么? 。画出氢氟酸溶液中最主要氢键 。
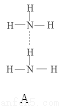
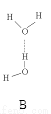
(3)DNA中四种碱基间通过氢键可能的配对方式,用虚线把氢键表示出来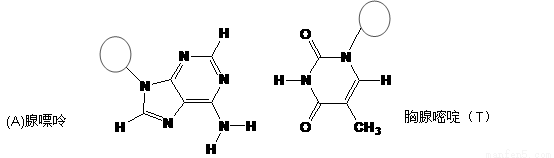

(4)试分析富马酸的K2大于其顺式异构体马来酸K2的原因。
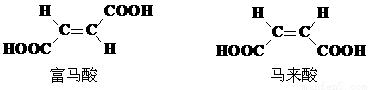
(5)下表是三种火箭推进剂的沸点,为什么火箭推进剂选择氮元素? 。
物质 | H2 | N2H4 | H2NN(CH3)2 |
沸点/℃ | -252.8 | 113.5 | ~116 |
(6)常压下,水冷却至0 ℃以下,即可结晶成六方晶系的冰。日常生活中见到的冰、霜和雪等都是属于这种结构,其晶胞如下图所示(只显示氧原子,略去氢原子),晶胞参数侧棱c=737 pm,菱形底边a=452 pm,底面菱形的锐角是60°。
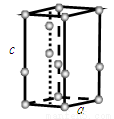
回答下列问题:
①计算晶胞中含有几个水分子。 ②计算冰的密度。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省洛阳市高三下学期统考二练理综化学试卷(解析版) 题型:填空题
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病,KI、KIO3曾先后用于加碘盐中。
(1)工业上可以通过铁屑法生产KI,其工艺流程如下:

①反应I生成铁与碘的化合物,若该化合物中铁元素与碘元素的质量比为21:127,则加入足量碳酸钾时,反应Ⅱ的化学方程式为 。
②操作A包括 ;用冰水洗涤的目的是 。
(2)KIO3可以通过H2O2氧化I2先制得HIO3,然后再用KOH中和的方法进行生产。
①烹饪时,含KIO3的食盐常在出锅前加入,其原因是 。
②若制得1284 kg KIO3固体,理论上至少需消耗质量分数为30%的双氧水 kg。
③KIO3还可通过下图所示原理进行制备。电解时总反应的离子方程式为 。若忽略溶液体积的变化,则电解结束后阴极区的pH与电解前相比 (选填“增大”、“减小”或“不变”)。
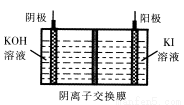
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省洛阳市高三下学期统考二练理综化学试卷(解析版) 题型:选择题
符合下列条件的有机物同分异构体共有(不考虑立体异构) ( )
①分子式为C6H14O ②在铜或银催化剂的条件下可以被空气中的氧气氧化为醛
A.6种 B.7种 C.8种 D.9种
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省洛阳市下学期期中考试高二化学试卷(解析版) 题型:选择题
某有机物能跟新制的氢氧化铜反应生成红色沉淀,相对分子质量为44。燃烧该有机物2.2 g生成2. 24 L(标准状况)CO2。下列说法不正确的是
A.该有机物属于醛类
B.1 mol该有机物一定条件下能与l mol H2加成
C.燃烧该有机物4.4 g,生成1.8 g水
D.0. 01 mol该有机物与足量银氨溶液充分反应,析出金属银2.16 g
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省高二上学期期末考试化学试卷(解析版) 题型:选择题
相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:
X2(g) + 3Y2(g)  2XY3(g) △H=-92.6 kJ·mol-1
2XY3(g) △H=-92.6 kJ·mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
X2 | Y2 | XY3 | ||
① | 1 | 3 | 0 | 放热 23.15 kJ |
② | 0.6 | 1.8 | 0.8 | Q(Q>0) |
下列叙述不正确的是
A.容器①、②中反应的平衡常数相等
B.容器②中反应达到平衡时放出的热量Q为23.15kJ
C.达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
D.若容器①体积为0.20 L,则达平衡时放出的热量大于23.15 kJ
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高一下学期期末考试化学试卷(解析版) 题型:填空题
五种短周期元素D、E、F、X、Y、Z的原子序数依次增大,D、E两元素最高正价与最低负价之和均为0,E元素的一种同位素常用于考古断代,D和X同主族,F和Y同主族,F的多种化合物可用作化肥,豆科植物的根瘤菌可将其单质转化为化合物,X和Z形成的二元化合物是厨房常用的调味品。回答下列问题:
(1)①E元素在元素周期表中的位置是_______________。
②由D和F,Y,Z所形成的最简单常见共价型化合物中,热稳定性最差的是__________(用化学式表示,下同);还原性最强的是_____________。
③F、X、Z形成的简单离子半径从大到小顺序为_________________(用离子符号表示)
④D、F、Z形成一种离子化合物,写出它的电子式________________________。
(2)①2012年,罗马大学科学家制造出F4分子,则F4和F2两种单质的关系是____________。
②F、X形成的一种二元离子化合物具有非常强的爆炸性,该物质中X的质量分数是35.38%,,则该物质的化学式为___________。
③Z单质和FD3发生置换反应,观察到有大量白烟生成,写出该反应化学方程式__________,反应中氧化剂和还原剂物质的量之比为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com