
【题目】国庆期间对大量鲜花施用了S-诱抗素制剂,以保证鲜花盛开。S-诱抗素的分子结构如图,说法正确的是

A.分子式C15H21O4
B.既能发生加聚反应,又能发生缩聚反应
C.分子中有两个手性碳原子
D.既能使氯化铁溶液发生显色反应,又能使酸性高锰酸钾溶液褪色
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】工业生产硫酸需经过SO2的制造、SO2的催化氧化和SO3的吸收三个主要阶段,下列说法错误的是( )
A.废渣可做建材B.将矿石粉碎增大反应速率
C.尾气直接排放D.热交换器提高能量利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,1mol·L-l的某二元酸H2A溶液中,存在的HA-、A2-的物质的量分数随pH变化的关系如图所示,
下列说法不正确的是
A. H2A的电离方程式为:H2A==H++HA- HA-![]() A2-+H+
A2-+H+
B. 室温下,电离平衡HA-![]() A2-+H+的平衡常数Ka=10-3。
A2-+H+的平衡常数Ka=10-3。
C. 等物质的量浓度NaHA和Na2A溶液等体积混合,离子浓度大小关系为:c(Na+)>c(HA-)>c(A2-)
D. 在Na2A溶液中存在c(Na+)=2c(A2-)+2c(HA-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与醋酸有关的反应方程式正确的是
A. 与烧碱反应:OH-+CH3COOH → CH3COO-+H2O
B. 与CaCO3反应:CO32-+2CH3COOH → 2CH3COO-+CO2↑+H2O
C. 乙醛氧化:CH3CHO+O2 ![]() CH3COOH
CH3COOH
D. 制乙酸乙酯:CH3COOH+C2H518OH ![]() CH3COOC2H5+H218O
CH3COOC2H5+H218O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的有机化工初始原料,可以由它出发合成很多有机产品,油漆软化剂丁烯酸乙酯的合成途径如下:

完成下列填空:
(1)丁烯酸乙酯的结构简式为______________________________。
(2)C→D的反应类型是____________。
A→B的化学方程式为___________________________________。
(3)写出一种D的同分异构体(与D含有完全相同的官能团)。_________________________________________
(4)请设计实验,检验D是否完全氧化为丁烯酸。____________________________
(5)设计一条由C制备ClCH2CH=CHCH2Cl的合成路线。(合成路线常用的表示方式为:A ![]() B
B ![]() 目标产物)_____________
目标产物)_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】180℃时将0.5 mol H2和1 mol CO2通入1 L的恒容密闭容器中,反应生成甲醇蒸汽(CH3OH)和某无机副产物,测得各物质的物质的量随时间的部分变化如图所示,下列说法中正确的是

A. 该反应的化学方程式:2CO2+4H2![]() 2CH3OH+O2
2CH3OH+O2
B. 在0~3 min内H2的平均化学反应速率为0.1 mol·L-1·min-1
C. 当容器内混合气体密度不再变化时,表明反应已经达到平衡状态
D. 在3~10 min内,反应仍未达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,在生活和生产中的应用十分广泛。
请回答:
(1)在工业上,“氯碱工业”是生产氯气的主要方法。请写出工业制备氯气的离子方程式__________________________。
(2)实验室常用MnO2 与浓盐酸反应制备Cl2,装置如图1所示:
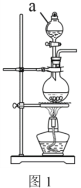
仪器a的名称为______。制备实验开始时,先检査装置气密性,接下来的操作依次是:___________(填序号)。
①往烧瓶中加入MnO2粉末 ②加热 ③往烧瓶中加入浓盐酸
(3)为证明Cl2与H2O反应为可逆反应,将生成的气体通入图2所示装置:

①装置A中应加入的试剂是____________。
②证明可逆反应,需验证在B中反应物和生成物同时存在,证明氯水中有Cl2存在的现象是______,仅使用一种试剂证明氯水中HCl和HClO均存在,合适的试剂是_____。
A.AgNO3溶液 B.石蕊试液
C.NaOH溶液 D.品红溶液
③装置C中NaOH溶液的作用是___________________。
(4)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度(残余液体积已知)。甲同学提出下列具体方案。请你从下列实验方案中选择合理的实验方法______。
A.在残余液中加入足量AgNO3溶液,过滤,洗涤,干燥,称量沉淀的质量
B.在残余液中加入足量NaHCO3固体,将反应后的气体直接用碱石灰吸收,测定生成的气体的质量
C.在残余液中加入足量锌片,测量生成气体的体积,折算成标准状况下的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5有机化合物】甲苯是有机化工生产的基本原料之一。利用乙醇和甲苯为原料,可按下列路线合成分子式均为C9H10O2的有机化工产品E和J。

已知:
请回答:
(1)写出下列反应方程式
①B+D→E______________________________________。
②G→H________________________________________。
(2)①的反应类型为__________;②的反应类型为__________;F的结构简式为__________。
(3)E、J有多种同分异构体,写出符合下列条件的4种同分异构体的结构简式。要求:①与E、J属同类物质②苯环上有两个取代基且苯环上的一氯代物只有两种。
__________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,a、b、c……为部分元素。回答下列问题:

(1)请写出上述元素c原子基态核外电子排布式_______________; d+基态核外电子排布式_______________________________。
(2)请写出一个能比较f、h非金属性强弱的反应的化学方程式___________________。
(3)请比较f、h、i 三种元素的第一电离能由大到小的顺序________(写元素符号);b、e、j三种元素的电负性由大到小的顺序________(写元素符号)。i2-与b+两种微粒半径大小: i2-___b+ (填>、=或<)。
(4)请写出e 元素最高价氧化物对应的水化物与a、b、i三种元素形成的化合物反应 的离子方程式___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com