
| 盐 | 熔点(℃) | 熔化吸热(kJ•mol-1) | 参考价格(元•t-1) |
| CaCl2•6H2O | 29.9 | 37.3 | 780~850 |
| Na2SO4•10H2O | 32.4 | 77.0 | 800~900 |
| Na2HPO4•12H2O | 35.1 | 100.1 | 1 600~2 000 |
| Na2S2O3•5H2O | 45.0 | 49.7 | 1 400~1 800 |
| A. | CaCl2•6H2O | B. | Na2SO4•10H2O | C. | Na2HPO4•12H2O | D. | Na2S2O3•5H2O |
科目:高中化学 来源: 题型:解答题
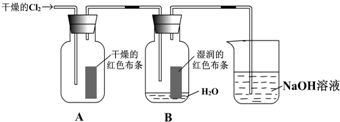
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 步骤(3)后可以确定CO32-一定不存在 | |
| B. | 忽略步骤(1)对实验结论并无影响 | |
| C. | 不能确定原溶液是否含有K+和Cl- | |
| D. | 若把步骤(2)产生的气体通入步骤(1)的滤液中,又可产生0.78g沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
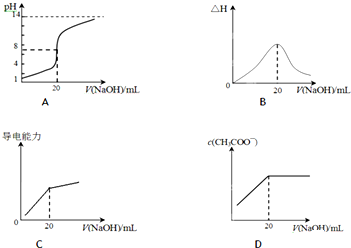 Ⅰ.常温下,某水溶液中只存在下列四种离子:Na+、A-、H+、OH-,据题意回答下列问题.
Ⅰ.常温下,某水溶液中只存在下列四种离子:Na+、A-、H+、OH-,据题意回答下列问题.| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | HCN | 5×10-10 |
| H2CO3 | Ka1=4.2×10-7 | HClO | 3×10-8 |
| Ka2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2晶体中每个硅原子与两个氧原子以共价键相结合 | |
| B. | 金属晶体的熔点都比分子晶体的熔点高 | |
| C. | 金刚石的晶胞中含有4个碳原子 | |
| D. | NaCl晶体中与每个Na+距离相等且最近的Na+共有12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;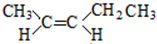 、
、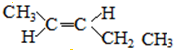 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
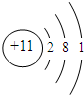 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
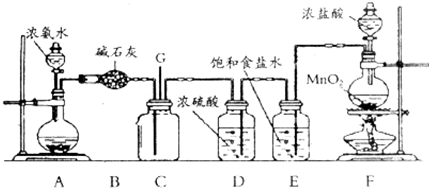
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com