
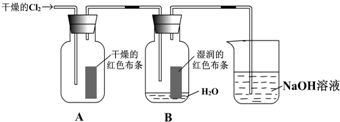
分析 Cl2与H2O反应生成HClO,反应的化学方程式为Cl2+H2O=HCl+HClO,具有漂白性的物质为HClO,如确证,可检验盐酸是否能使红布条褪色,干燥的氯气不具有漂白性,不能使干燥有色布条褪色,氯气可与氢氧化钠反应生成氯化钠、次氯酸钠和水,可用于氢氧化钠吸收尾气,以此解答该题.
解答 解:(1)通入Cl2后,干燥的氯气没有漂白性,集气瓶A中干燥的红色布条不褪色,Cl2与H2O反应生成HClO,反应的化学方程式为Cl2+H2O=HCl+HClO,具有漂白性的物质为HClO,则集气瓶B中湿润的红色布条褪色,
故答案为:不褪色;褪色;干燥Cl2没有漂白性,Cl2与水反应生成 HClO有漂白性;
(2)Cl2+H2O?HCl+HClO,所以需要设计一个实验在一个红色布条上滴加盐酸,布条无变化,排除氯化氢的漂白性,就证明起漂白作用的物质是次氯酸,
故答案为:盐酸是否能使红布条褪色.
点评 本题考查HClO的漂白性的探究,题目难度不大,本题注意氯气与次氯酸性质的差异性,注意有关反应化学方程式或者离子方程式的书写,把握反应的原理.


科目:高中化学 来源: 题型:选择题
| A. | 1mol C2H6含有6nA个共价键 | |
| B. | 标准状况下,22.4L氯水含有nA个Cl2分子 | |
| C. | 17gNH3含有10nA个质子 | |
| D. | 1molK被完全氧化生成KO2,失去2nA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷的分子式是C3H6 | |
| B. | 丙烷分子中的碳原子在一条直线上 | |
| C. | 丙烷在光照条件下能够发生取代反应 | |
| D. | 丙烷的熔点比乙烷低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中可能含有共价键 | B. | 共价化合物中一定不含离子键 | ||
| C. | 离子化合物中肯定只含离子键 | D. | 共价化合物中含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
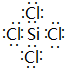 .
. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
| 0.10mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50mol/L 稀硫酸 | |||
| ① | 30 | 20 | 30 | 20 | 18 | |
| ② | 30 | 20 | 30 | 20 | 温度65℃ | 13 |
| ③ | 30 | 20 | 30 | 20 | 少量MnSO4固体 | 3.6 |
| ④ | 30 | 20 | x | 20 | 5mL 10mol/L K2SO4溶液 | 18 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 盐 | 熔点(℃) | 熔化吸热(kJ•mol-1) | 参考价格(元•t-1) |
| CaCl2•6H2O | 29.9 | 37.3 | 780~850 |
| Na2SO4•10H2O | 32.4 | 77.0 | 800~900 |
| Na2HPO4•12H2O | 35.1 | 100.1 | 1 600~2 000 |
| Na2S2O3•5H2O | 45.0 | 49.7 | 1 400~1 800 |
| A. | CaCl2•6H2O | B. | Na2SO4•10H2O | C. | Na2HPO4•12H2O | D. | Na2S2O3•5H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com