
【题目】CO2通入BaCl2溶液中并不产生沉淀,在下图右侧的Y形管中放置合适的药品,进行合理操作,在BaCl2溶液中可以看到白色沉淀.右侧Y形管中放的药品是( )

A. Cu和浓硝酸 B. CaO和浓氮水
C. Na2SO3和较浓硫酸 D. KMnO4溶液和浓盐酸
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案科目:高中化学 来源: 题型:
【题目】两份体积相同,浓度未知的Na2CO3和HCl溶液,将它们互相滴加,产生的气体在相同的温度和压强下的体积比为1:3,则Na2CO3和HCl溶液的浓度之比为( )
A. 5:6 B. 2:5 C. 3:4 D. 5:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界水体中的碳元素主要以碳酸盐、碳酸氢盐和有机物形式存在。水体中有机物含量是水质的重要指标,常用总有机碳衡量(总有机碳=![]() )。某学生兴趣小组用如下实验方法测定采集水样的总有机碳。
)。某学生兴趣小组用如下实验方法测定采集水样的总有机碳。

步骤1:量取50 mL水样,加入足量硫酸,加热,通N2,并维持一段时间(装置如图,夹持类仪器省略)。
步骤2:再向水样中加入过量的K2Cr2O7溶液(可将有机物中的碳元素氧化成CO2),加热,充分反应,生成的CO2完全被100mL 0.206 mol·L-1的Ba(OH)2溶液吸收。
步骤3:将吸收CO2后的浊液过滤并洗涤沉淀,再将洗涤得到的滤液与原滤液合并,加水配制成500mL溶液。量取25.00mL溶液于锥形瓶中,加入几滴酚酞试剂,并滴加0.05mol·L-1的H2C2O4溶液,发生反应:Ba(OH)2+H2C2O4===BaC2O4↓+2H2O 恰好完全反应时,共消耗H2C2O4溶液20.00 mL。
(1)步骤1的目的是____。
(2)用H2C2O4溶液滴定至终点时,溶液颜色变化是____。
(3)计算水样的总有机碳(以mg·L-1表示),并写出计算过程。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和实验现象所得到的实验结论正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向亚硫酸钠试样中滴入盐酸酸化的Ba(C1O)2溶液 | 产生白色沉淀 | 试样已氧化变质 |
B | 向氯仿样品中加入硝酸银溶液 | 有白色沉淀产生 | 样品已变质 |
C | 向待测液中依次滴入氯水和KSCN溶液 | 溶液变为红色 | 待测液中含有Fe2+ |
D | 向NaHCO3溶液中滴加NaAlO2溶液 | 有白色沉淀和气体产生 | AlO2-与HCO3-发生了双水解反应 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3 为中学化学中经常使用的物质,长郡化学实验小组为探究 FeCl3 的性质,进行了如下实验。
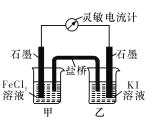
(1)学习小组 A 为探究 FeCl3与 KI 溶液的反应,特设计如右图所示的原电池实 验装置。在实验过程中,学习小组 A 发现,灵敏电流计的指针先偏转,最后 示数为零。若此时向甲中加入适量 FeCl2 固体,灵敏电流计的指针又发生偏转 此时________(填“甲”或“乙”)中石墨电极为负极,对应的电极反应方程式为_________
(2)学习小组 B 把 FeCl3 溶液分别加入Na2CO3 溶液和Na2SO3溶液中,发现有如下实验现象:
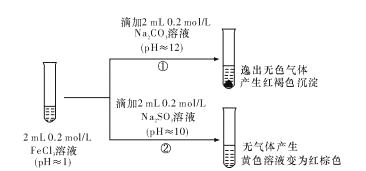
对于②中的实验现象,学习小组 B 的同学们有诸多猜测,继续进行实验: I.小明取②中的红棕色溶液少许,滴入盐酸酸化的 BaCl2溶液,产生白色沉淀。小明得出结论:FeCl3 与 Na2SO3 发生了氧化还原反应,离子方程式是_____。
Ⅱ,小红认为小明的实验不严谨,重新设计实验方案并进行实验,证实了小明的结论是正确的。其实验方 案是______________________________。
(3)学习小组 C 进一步探究 FeCl3 溶液与足量锌粉的反应。实验操作及实验现象如下表所示:

已知:Zn 的化学性质与 Al 相似,能发生反应![]()
①结合实验现象和平衡移动原理解释出现红褐色沉淀的原因:______
②分离出黑色固体,经下列实验证实了其中含有的主要物质。
i.黑色固体可以被磁铁吸引
ii.向黑色固体中加入足量的 NaOH 溶液,产生气泡;
iii.将 ii 中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡; iv.向 iii 反应后的溶液中滴加 KSCN 溶液,无变化。 a.黑色固体中一定含有的物质是_____。
b.学习小组 C 认为上述实验无法确定黑色固体中是否含有 Fe3O4,理由是__________________
(4)为进一步探究 1.0 mol/L FeCl3 溶液中 Fe3+和 H+氧化性的相对强弱,学习小组 C 补充实验并观察到反应开始时的实验现象如下表所示:
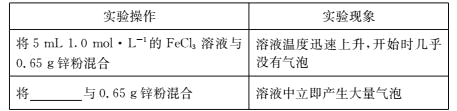
学习小组 C 得出结论:在 1.0 mol/L FeCl3 溶液中,Fe3+的氧化性比 H+强。则表格中横杠处应填____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方案的设计或描述及对应的离子方程式正确的是
A. 用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+ = Cu2+ + 2Fe2+
B. 将氯气溶于水制备次氯酸:Cl2 + H2O = 2H+ + Cl- + ClO-
C. 等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合Ca2+ + 2HCO3- +2OH-=CaCO3↓+CO32-+2H2O
D. 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO![]() + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
+ 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com