
【题目】下图中的每一方格表示有关的一种反应物或生成物,其中甲、乙、丙、丁为常见单质,其余均为化合物。A是一种常见的液态化合物,B是具有磁性的氧化物,D和丁既能和酸反应又能和碱反应,乙在丙中燃烧产生苍白色火焰,H在空气中很容易被氧化为I2。它们的转化关系如下:(有些反应的条件和部分产物为注明)
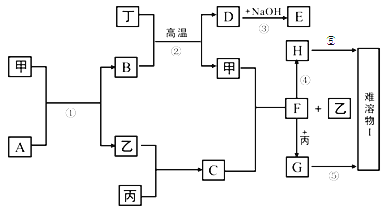
(1)写出下列物质化学式:B_________,F_______________;
(2)写出反应①的化学方程式:____________________;
(3)H在空气中很容易被氧化为I,该过程的实验现象是__________________;
(4)将足量的CO2通入E溶液中,离子方程式是___________________。
(5)将G的饱和溶液滴入沸水中得红褐色液体,该液体具有的性质有__________。
A.具有丁达尔现象 |
B.红褐色液体可用过滤的方法纯化 |
C.液体中分散质微粒直径小于1nm |
D.取适量液体加入K2SO4溶液会产生红褐色沉淀 |
【答案】Fe3O4 FeCl2 3Fe+4H2O![]() Fe3O4+4H2 白色沉淀逐渐变为灰绿色,最终变为红褐色沉淀 AlO2-+CO2+H2O=Al(OH)3↓+HCO3- AD
Fe3O4+4H2 白色沉淀逐渐变为灰绿色,最终变为红褐色沉淀 AlO2-+CO2+H2O=Al(OH)3↓+HCO3- AD
【解析】
甲、乙、丙、丁为常见单质,其余均为化合物,A是一种常见的液态化合物,则A为H2O,B是具有磁性的氧化物,则B为Fe3O4,D和丁既能和酸反应又能和碱反应,则丁为Al,D为Al2 O3 ,E为NaAlO2 ,乙在丙中燃烧产生苍白色火焰,则C为HCl,结合转化关系可知,甲为Fe,乙为H2,F为FeCl2 ,H在空气中很容易被氧化成I,则H为Fe(OH)2 ,I为F(OH)3 ,G为FeCl3 。
(1)通过以上分析知,B、F分别是Fe3O4;FeCl2;
(2)A与甲反应的化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(3)H为Fe(OH)2,I为F(OH)3 ,氢氧化亚铁是白色沉淀、氢氧化铁是红褐色沉淀,氢氧化亚铁不稳定,极易被空气中氧气氧化生成红褐色氢氧化铁沉淀,看到的现象是白色沉淀逐渐变为灰绿色,最终变为红褐色沉淀;
(4)E是偏铝酸钠,足量二氧化碳通入偏铝酸钠溶液中反应生成氢氧化铝沉淀和碳酸氢钠,离子方程式为AlO2-+CO2+H2O=Al(OH)3↓+HCO3-;
(5)将G的饱和溶液滴入沸水中得红褐色液体,该液体是Fe(OH)3胶体,具有丁达尔效应,其分散质直径在1-100nm之间,能透过滤纸但不能透过半透膜,能和电解质溶液发生聚沉现象,选项AD正确。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】25℃时,向浓度均为0.1mol/L、体积均为100mL的两种一元酸HX、HY溶液中分别加入NaOH固体,溶液中lg![]() 随n(NaOH)的变化如下图所示。下列说法不正确的是
随n(NaOH)的变化如下图所示。下列说法不正确的是

A. HX为强酸,HY为弱酸 B. b点时溶液呈中性
C. 水的电离程度:d>c D. c点时溶液的pH=4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)=2HF(g)+270KJ,下列说法正确的是
A.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270KJ热量
B.2L氟化氢气体分解成1L氢气与1L氟气吸收270KJ热量
C.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出热量大于270KJ
D.该反应过程的能量变化可用图来表示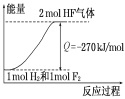
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电解NaOH溶液即电解水:2H2O![]() 2H2↑+O2↑。现对100g 11.7%的NaCl溶液进行电解,总共通过电子0.4mol。
2H2↑+O2↑。现对100g 11.7%的NaCl溶液进行电解,总共通过电子0.4mol。
(1)在阴极产生的氢气的体积(按标准状况计)为______
(2)阳极产生的氧气的物质的量为__________
(3)假定控制条件使Cl2未从电解液中逸出,电解结束后经充分搅拌Cl2与NaOH发生了完全反应,生成NaClO和部分NaClO3。求完全反应后电解池中三种钠盐的总质量____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。
(1)实验中应选用___作指示剂。
(2)用标准的NaOH溶液滴定待测的白醋时,如何判断滴定终点:___。
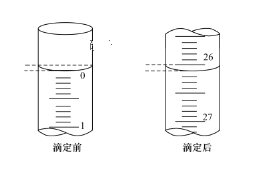
(3)第一次滴定前后,碱式滴定管中的液面位置如图所示,则V标=__mL。
(4)下列有关中和滴定的操作:①用标准液润洗滴定管;②往滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤滴加指示剂于待测液;⑥洗涤。
正确的操作顺序是____
A.⑤④③②①⑥ B.⑤①②⑥④③
C.③⑥①②⑤④ D.③⑥①②④⑤
(5)滴定过程中进行如下操作,分别指出该项操作对滴定结果的影响(填“偏高”、“偏低”或“无影响”)
Ⅰ.滴定前未用标准液润洗碱式滴定管___;
Ⅱ.滴定结束时俯视滴定管刻度___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.1mol·L-1的NaOH溶液分别滴定相同浓度的弱酸HX、HY的稀溶液,其滴定曲线如图所示。下列说法错误的是( )
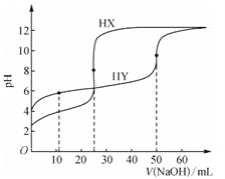
A.HX的酸性比HY的强B.滴定过程中,均可用酚酞作指示剂
C.室温下,Ka(HY)的数量级约为10-4 D.滴定前,HY的体积为HX的两倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质M是一种日常生活中不可缺少的调味品。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):
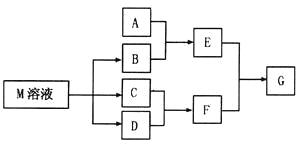
(1)写出用惰性电极电解M溶液的离子方程式_______________________。
(2)若A是一种酸性氧化物,且可用于制造玻璃,则G的化学式是_________________。
(3)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是_______________。
(4)若A是一种盐,A溶液与B溶液混合产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,则由A转化成E的离子方程式是__________________________________。
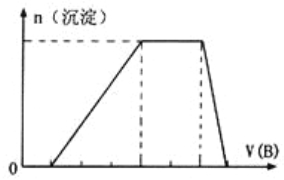
(5)若A是一种溶液,只可能含有![]() 中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为_________。
中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中的离子一定能大量共存的是( )
A.含大量H+的溶液中:Na+、K+、SO42-、HCO3-
B.在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3-
C.能使酚酞变红的溶液中:Na+、NO3-、K+、AlO2-
D.含大量Fe3+的溶液中:NH4+、Na+、I-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是一种有效的抗疟药。常温下,青蒿素为无色针状晶体,难溶于水,易溶于有机溶剂,熔点为156~157℃。提取青蒿素的方法之一是乙醚浸取法,提取流程如下:

请回答下列问题:
(l)对青蒿进行破碎的目的是__________________。
(2)操作I用到的玻璃仪器是__________,操作Ⅱ的名称是_______。
(3)用下列实验装置测定青蒿素的化学式,将28.2g青蒿素放在燃烧管C中充分燃烧:

① 仪器各接口的连接顺序从左到右依次为_______(每个装置限用一次)。A装置中发生的化学反应方程式为_________________。
② 装置C中CuO的作用是_________________。
③ 装置D中的试剂为_________________。
④ 已知青蒿素是烃的含氧衍生物,用合理连接后的装置进行实验.测量数据如下表:
装置质量 | 实验前/g | 实验后/g |
B | 22.6 | 42.4 |
E(不含干燥管) | 80.2 | 146.2 |
则青蒿素的最简式为__________。
(4)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH 、酚酞的水溶液中,青蒿素的溶解度较小,加热并搅拌,青蒿素的溶解度增大,且溶液红色变浅,与青蒿素化学性质相似的物质是______(填字母代号)。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com