
【题目】已知电解NaOH溶液即电解水:2H2O![]() 2H2↑+O2↑。现对100g 11.7%的NaCl溶液进行电解,总共通过电子0.4mol。
2H2↑+O2↑。现对100g 11.7%的NaCl溶液进行电解,总共通过电子0.4mol。
(1)在阴极产生的氢气的体积(按标准状况计)为______
(2)阳极产生的氧气的物质的量为__________
(3)假定控制条件使Cl2未从电解液中逸出,电解结束后经充分搅拌Cl2与NaOH发生了完全反应,生成NaClO和部分NaClO3。求完全反应后电解池中三种钠盐的总质量____
【答案】4.48L 0.05mol 13.3g
【解析】
电解NaCl溶液时,阳极上氯离子先放电生成氯气,当氯离子完全析出后,氢氧根离子放电生成氧气;阴极上氢离子放电生成氢气。
(1)100g11.7%的NaCl溶液中,![]() ,阴极上电极反应式为2H++2e-=H2,通过的电子为0.4mol,则生成氢气在标况下体积为
,阴极上电极反应式为2H++2e-=H2,通过的电子为0.4mol,则生成氢气在标况下体积为
![]() 。
。
(2)阳极上氯离子完全电解转移的电子为0.2mol,因此氢氧根离子电解时转移的电子为0.2mol,4OH--4e-=2H2O+O2,根据氧气和转移电子之间的关系得,生成得氧气的物质的量为![]() 。
。
(3)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和NaClO3。根据氯元素守恒可知![]() 。原来的盐为氯化钠,现在的盐为氯化钠、次氯酸钠和NaClO3,可知完全反应后三种钠盐的质量等于原氯化钠的质量加上氧元素的质量。设反应后n(NaCl)=x,n(NaClO)=y,n(NaClO3)=z,根据氯原子守恒及得失电子守恒得:
。原来的盐为氯化钠,现在的盐为氯化钠、次氯酸钠和NaClO3,可知完全反应后三种钠盐的质量等于原氯化钠的质量加上氧元素的质量。设反应后n(NaCl)=x,n(NaClO)=y,n(NaClO3)=z,根据氯原子守恒及得失电子守恒得:![]() ,解得y+3z=0.1mol。完全反应后电解池中三种钠盐得总质量=原来氯化钠的质量+氧元素的质量为
,解得y+3z=0.1mol。完全反应后电解池中三种钠盐得总质量=原来氯化钠的质量+氧元素的质量为![]() 。
。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】我国科学家借助自主研制的新型钨钴铁合金催化剂攻克了单壁碳纳米管结构的可控制备难题。海底金属软泥是在海底覆盖着的一层红棕色沉积物,蕴藏着大量的金属资源,含有钨、铁、锰、锌、钴等。
(1)基态钴原子的核外未成对电子数为__________。单壁碳纳米管可看作石墨烯沿一定方向卷曲而成的空心圆柱体,其碳原子的杂化方式为__________。
(2)纳米结构氧化钴可在室温下将甲硫醛(CH2S)完全催化氧化,甲醛分子属__________(填“极性”或“非极性”)分子,其中心原子的VSEPR构型为__________。
(3)六羰基钨[W(CO)6]的熔点为172℃,是一种重要的无机金属配合物,可溶于多数有机溶剂。三种组成元素的电负性由大到小的顺序为 __________(用元素符号表示)。配体CO中与W形成配位键的原子是C而不是O,原因是 ____________。
(4)多原子分子中各原子若在同一平面内,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”。下列物质中存在“离域π键”的是 ____________(填字母)。
A.苯 B.二氧化硫 C.四氯化碳 D.环己烷
(5) Fe2+、Fe3+能与CN-形成络离子,其晶胞结构如图1所示。该离子可形成铁蓝钾盐,该钾盐的化学式为___________。
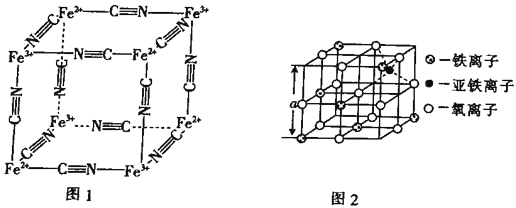
(6)图2是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,该立方体是不是Fe3O4的晶胞__________(填“是”或“否”);立方体中铁离子处于氧离子围成的 _________(填空间结构)空隙;根据上图计算Fe3O4晶体的密度为 ________gcm-3。(图中a=0.42nm,计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钙[Ca(NO2)2]是易溶于水的无色晶体,可用作水泥硬化促进剂和防冻阻锈剂等。实验室可通过反应Ca(NO3)2+CaFe2O4+NO→Ca(NO2)2+Fe2O3(未配平)制备高纯度的亚硝酸钙,装置如图所示:
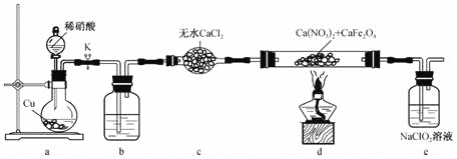
下列说法错误的是( )
A.装置b中盛放的试剂为浓硫酸 B.向烧瓶中加入稀硝酸前需打开K
C.装置e主要用于除去尾气中的NO D.d中每生成1 mol Ca(NO2)2,转移 ![]() mol电子
mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将a g二氧化锰粉末加入b mol/L的浓盐酸c L中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是
A.可以收集到氯气![]() L
L
B.NA可表示为:![]()
C.反应后溶液中的Cl―数目为:![]()
D.反应后溶液中的H+数目为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B.P4和CH4都是正四面体形分子且键角都为109°28′
C.![]() 的电子式为
的电子式为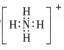 ,离子呈平面正方形结构
,离子呈平面正方形结构
D.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热化学:(1)已知:C(s)+H2O(l)=CO(g)+H2(g) ΔH1=a kJ·mol-1;
2CO(g)+O2(g)=2CO2(g) ΔH2=bkJ·moL-1;
2H2(g)+O2(g)=2H2O(l) ΔH3=ckJ·moL-1;
则C(s)+O2(g)=CO2(g) ΔH=___(用a、b、c表示)kJ·moL-1。
(2)根据键能数据估算CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热ΔH=___。
化学键 | C—H | C—F | H—F | F—F |
键能(kJ·mol-1) | 414 | 489 | 565 | 155 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的每一方格表示有关的一种反应物或生成物,其中甲、乙、丙、丁为常见单质,其余均为化合物。A是一种常见的液态化合物,B是具有磁性的氧化物,D和丁既能和酸反应又能和碱反应,乙在丙中燃烧产生苍白色火焰,H在空气中很容易被氧化为I2。它们的转化关系如下:(有些反应的条件和部分产物为注明)
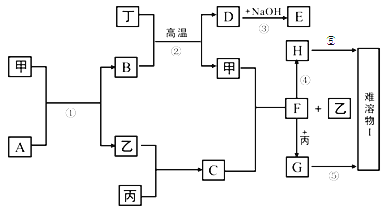
(1)写出下列物质化学式:B_________,F_______________;
(2)写出反应①的化学方程式:____________________;
(3)H在空气中很容易被氧化为I,该过程的实验现象是__________________;
(4)将足量的CO2通入E溶液中,离子方程式是___________________。
(5)将G的饱和溶液滴入沸水中得红褐色液体,该液体具有的性质有__________。
A.具有丁达尔现象 |
B.红褐色液体可用过滤的方法纯化 |
C.液体中分散质微粒直径小于1nm |
D.取适量液体加入K2SO4溶液会产生红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K时,把0.1molN2O4气体通入体积为lL的恒容密闭容器中,立即出现红棕色。在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A.压缩容器,颜色变浅
B.在平衡时体系内含N2O40.04mol
C.以N2O4的浓度变化表示的平均反应速率为0.002mol/(L·s)
D.平衡时,如果再充入一定量N2O4,则可提高N2O4的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用软锰矿(主要成分为MnO2)生产高锰酸钾产生的锰泥中,还含有18%的MnO2、3%的KOH(均为质量分数),及少量Cu、Pb的化合物等,用锰泥可回收制取MnCO3,过程如图:

(1)高锰酸钾的氧化性强弱与溶液的酸碱性有关,在酸性条件下其氧化性较强。通常用来酸化高锰酸钾的酸是______
A.H2SO4 B.HCl C.HNO3
(2)除去滤液1中Cu2+的离子方程式是___________________________
(3)经实验证明:MnO2稍过量时,起始H2SO4、FeSO4混合溶液中![]() <0.7时,滤液1中能够检验出有Fe2+;
<0.7时,滤液1中能够检验出有Fe2+;![]() ≥0.7时,滤液1中不能检验出有Fe2+。根据上述信息回答①②:
≥0.7时,滤液1中不能检验出有Fe2+。根据上述信息回答①②:
①检验Fe2+是否氧化完全的实验试剂是__________ A.KSCN B.K3Fe(CN)6
②若![]() >1,调节
>1,调节![]() 到0.7~1的最理想试剂是_______(填序号)
到0.7~1的最理想试剂是_______(填序号)
a.NaOH溶液 b.铁粉 c.MnO。
(4)写出滤液2中加入过量NH4HCO3反应的离子方程式__________。
(5)上述过程锰回收率可达95%,若处理1740 kg的锰泥,可生产MnCO3__________kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com