
【题目】将a g二氧化锰粉末加入b mol/L的浓盐酸c L中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是
A.可以收集到氯气![]() L
L
B.NA可表示为:![]()
C.反应后溶液中的Cl―数目为:![]()
D.反应后溶液中的H+数目为:![]()
【答案】B
【解析】
A、固体全部溶解说明二氧化锰完全反应,盐酸是过量,生成的氯气可以依据二氧化锰计算,依据化学方程式MnO2+4HCl=MnCl2+Cl2↑+2H2O,二氧化锰物质的量和氯气物质的量相同,可以收集到氯气体积=(a/87)×22.4 =22.4a/87L,A错误;
B、依据电子转移守恒,MnO2~MnCl2~2e-,(a/87)×2×NA=d,得到NA=87d/2a,,B正确;
C、反应后溶液中的Cl-数目为(bc-a/87×2)×NA,选项中 只是计算得到生成的氯化锰中的氯离子,盐酸过量的没减少在内,C错误;
D、反应后溶液中的H+数目为(bc-a/87×4)NA,D错误;
答案选B。


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下面两表分别列出了CO和N2 的某些性质及相关键能,有关说法不正确的是
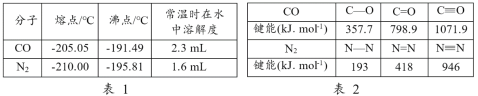
A.CO与N2的价电子总数相等
B.由表2可知,CO的活泼性不及N2
C.由表1可知,CO的熔沸点高于N2,是因为CO分子间作用力大于N2
D.由表2可知,σ键的稳定性不一定强于π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。
某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
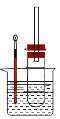
实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH溶液和5 mL 溴乙烷,振荡。
实验操作II:将试管如图固定后,水浴加热。
(1)用水浴加热而不直接用酒精灯加热的原因是_______________________________。
(2)观察到_________________________现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)鉴定生成物中乙醇的结构,可用的波谱是_________________________________。
(4)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是______________________,检验的方法是_____________(需说明:所用的试剂、简单的实验操作及预测产生的实验现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业用黄铜矿(主要成分CuFeS2,含少量锌、铅的硫化物)冶炼铜的一种方法如下:
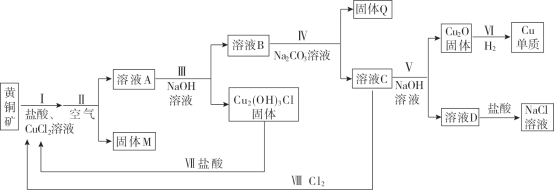
(1)Ⅰ中发生下列反应。ⅰ.CuFeS2 + 3Cu2+ + 4Cl- = 4CuCl+ Fe2+ +2Sⅱ. CuCl + Cl-![]() CuCl2-,I中盐酸的作用是________。
CuCl2-,I中盐酸的作用是________。
(2)Ⅱ中通入空气,将Fe2+转化FeOOH沉淀。
①Fe2+转化为FeOOH的离子方程式是__________。
②溶液A中含金属元素的离子有:Zn2+、Pb2+和________。
(3)Ⅲ中需控制NaOH溶液的用量,其原因是________。
(4)Ⅳ中加入Na2CO3溶液的目的是________。
(5)V中反应的离子方程式是________。
(6)从物质循环利用的角度分析,如何处理NaCl溶液才能更好地服务于该冶炼铜的工艺,并说明理由:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.已知 C-C 键可以绕键轴自由旋转,结构简式为: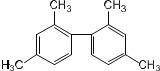 分子中至少有 11 个碳原子处于同一平面上
分子中至少有 11 个碳原子处于同一平面上
B.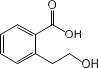 能发生的反应类型有:加成反应、取代反应、消去反应、酯化反应、 水解反应
能发生的反应类型有:加成反应、取代反应、消去反应、酯化反应、 水解反应
C.3-甲基-3-乙基戊烷的一氯取代产物为 5 种
D.相同条件下乙酸乙酯在水中的溶解度比在乙醇中的溶解度要大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容容器中进行如下反应:N2+3H2![]() 2NH3 △H<0,温度一定时,若将平衡体系中各物质的浓度都增加到原来的2倍,不会产生的结果是( )
2NH3 △H<0,温度一定时,若将平衡体系中各物质的浓度都增加到原来的2倍,不会产生的结果是( )
A. 平衡向正反应方向移动B. 平衡向逆反应方向移动
C. NH3的百分含量增加D. 正、逆反应速率都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含Cr2O72-废水用硫酸亚铁铵[FeSO4(NH4)2SO46H2O]处理,反应中铁元素和铬元素完全转化为沉淀,该沉淀干燥后得到nmolFeOFeyCrxO3(提示:其中Cr为+3价)。不考虑处理过程中的实际损耗,下列叙述错误的是
A.消耗硫酸亚铁铵的物质的量为n(3x+l)mol
B.处理废水中Cr2O72-的物质的量为(nx/2)mol
C.反应中发生转移的电子的物质的量为6nxmol
D.在FeOFeyCrxO3中3x=y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)的合成与应用具有广阔的发展前景。
Ⅰ.合成甲醇的部分工艺流程如下:
![]()
(1)甲烷与水蒸气反应制备合成甲醇的原料气CO、CO2和H2。CH4(g)+H2O(g)=CO(g)+3H2(g) 、H =+206.2 kJ·mol-1,CO(g) + H2O(g) =CO2(g) + H2(g)H =41.0 kJ·mol-1,甲烷与水蒸气反应生成CO2和H2的热化学方程式为________。
(2)在催化剂的作用下,200~300℃时,合成反应器内发生反应:ⅰ. CO(g)+2H2(g)![]() CH3OH(g)H<0,ⅱ.CO2(g)+3H2(g)
CH3OH(g)H<0,ⅱ.CO2(g)+3H2(g)![]() CH3OH(g) + H2O(g)H<0。
CH3OH(g) + H2O(g)H<0。
①一段时间内,记录合成反应器出、入口样品的温度,数据如图所示。曲线_________是合成反应器出口样品的温度。
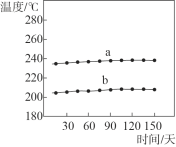
②如果你是工程师,请对合成反应器中压强的控制提出建议并说明理由:_______。合成反应器中有少量的副反应,会生成二甲醚(CH3OCH3)、甲酸甲酯等。已知沸点:甲醇 64.7℃;二甲醚 -24.9℃;甲酸甲酯32.0℃。
③CO和H2生成二甲醚的化学方程式是_________。
④从合成反应器出来的产品经分离提纯可以得到甲醇,请简述该方法_______。
Ⅱ.下图为甲醇燃料电池的示意图。
(3)①负极的电极反应式是_______。
②质子交换膜材料的合成是燃料电池的核心技术。我国科研人员研发的一种质子交换膜材料的结构片段如下,它由三种单体缩聚而成。
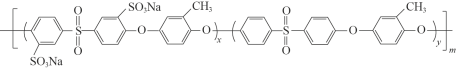
已知:ROH + R’Cl → R—O—R’ + HCl,单体的结构简式是: 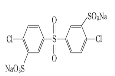 、 _____、___。
、 _____、___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯水的叙述,不正确的是( )
A. 新制的氯水中,溶质既有分子又有离子
B. 新制的氯水是无色透明的液体,有酸性和漂白性
C. 光照氯水有气泡逸出,该气体是O2
D. 氯水放置数天后酸性将增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com