
【题目】甲醇(CH3OH)的合成与应用具有广阔的发展前景。
Ⅰ.合成甲醇的部分工艺流程如下:
![]()
(1)甲烷与水蒸气反应制备合成甲醇的原料气CO、CO2和H2。CH4(g)+H2O(g)=CO(g)+3H2(g) 、H =+206.2 kJ·mol-1,CO(g) + H2O(g) =CO2(g) + H2(g)H =41.0 kJ·mol-1,甲烷与水蒸气反应生成CO2和H2的热化学方程式为________。
(2)在催化剂的作用下,200~300℃时,合成反应器内发生反应:ⅰ. CO(g)+2H2(g)![]() CH3OH(g)H<0,ⅱ.CO2(g)+3H2(g)
CH3OH(g)H<0,ⅱ.CO2(g)+3H2(g)![]() CH3OH(g) + H2O(g)H<0。
CH3OH(g) + H2O(g)H<0。
①一段时间内,记录合成反应器出、入口样品的温度,数据如图所示。曲线_________是合成反应器出口样品的温度。
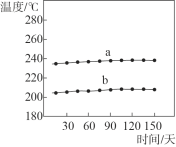
②如果你是工程师,请对合成反应器中压强的控制提出建议并说明理由:_______。合成反应器中有少量的副反应,会生成二甲醚(CH3OCH3)、甲酸甲酯等。已知沸点:甲醇 64.7℃;二甲醚 -24.9℃;甲酸甲酯32.0℃。
③CO和H2生成二甲醚的化学方程式是_________。
④从合成反应器出来的产品经分离提纯可以得到甲醇,请简述该方法_______。
Ⅱ.下图为甲醇燃料电池的示意图。
(3)①负极的电极反应式是_______。
②质子交换膜材料的合成是燃料电池的核心技术。我国科研人员研发的一种质子交换膜材料的结构片段如下,它由三种单体缩聚而成。
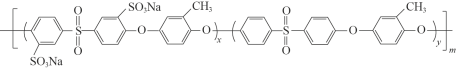
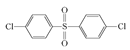
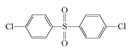
已知:ROH + R’Cl → R—O—R’ + HCl,单体的结构简式是: 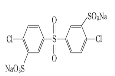 、 _____、___。
、 _____、___。
【答案】CH4(g) + 2H2O(g) =CO2(g) + 4H2(g) H = +165.2kJ·mol-1 a 适当加压。加压能使该反应速率增大、原料转化率升高,也会增加设备和动力成本 2CO+4H2 ![]() CH3OCH3+ H2O 降温冷凝得到液态甲醇粗品再蒸馏提纯 CH3OH-6e-+H2O = CO2+6H+
CH3OCH3+ H2O 降温冷凝得到液态甲醇粗品再蒸馏提纯 CH3OH-6e-+H2O = CO2+6H+ 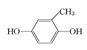
 或
或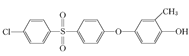
【解析】
I、(1)应用盖斯定律写出热化学方程式;
(2)①两个反应都是放热反应,合成反应器出口样品的温度更高一些;
②两个反应都是气体体积减小的反应,从平衡的角度来看,高压更合适,但是压强高,意味着设备要好,这就需要加大成本的投入,因此需要适当加压;
③题中告知反应物和生成物,写完整方程式即可;
④题中给出了几个物质的沸点,甲醇的沸点较高,且和其他物质的沸点相差较大,可以通过降温冷凝的方法得到甲醇;
II、(3)①燃料电池的构造中有质子交换膜,则说明反应中产生H+,故负极电极反应为:CH3OH-6e-+H2O=CO2+6H+;
②结合题中给出的方程式分析即可。
I、(1)根据盖斯定律,将两个热化学方程式加起来得:CH4(g)+2H2O(g)=CO2(g)+4H2(g) H=+165.2kJ·mol-1;
(2)①两个反应都是放热反应,合成反应器出口样品的温度更高一些,故选a;
②两个反应都是气体体积减小的反应,从平衡的角度来看,增大压力,能使该反应速率增大、原料转化率升高,但是压强高,意味着设备要好,这就需要加大成本的投入,因此需要适当加压;
③CO和H2生成二甲醚的化学方程式为:2CO+4H2![]() CH3OCH3+H2O;
CH3OCH3+H2O;
④题中给出了几个物质的沸点,甲醇的沸点较高,且和其他物质的沸点相差较大,可以通过降温冷凝的方法得到甲醇粗品,再经过蒸馏提纯;
II、(3)①燃料电池的构造中有质子交换膜,则说明反应中产生H+,故负极电极反应为:CH3OH-6e-+H2O=CO2+6H+;
②结合题中给出的化学方程式,可以推出另外两种单体分别为: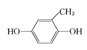 、
、 或
或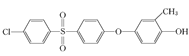 。
。


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】有下列几组物质,请将序号填入下列空格内:
A、CH2=CH﹣COOH和油酸(C17H33COOH)
B、12C60和石墨
C、![]() 和
和![]()
D、35Cl和37Cl
E、乙醇和乙二醇
(1)互为同位素的是 ;
(2)互为同系物的是 ;
(3)互为同素异形体的是 ;
(4)互为同分异构体的是 ;
(5)既不是同系物,又不是同分异体,也不是同素异形体,但可看成是同一类物质的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将a g二氧化锰粉末加入b mol/L的浓盐酸c L中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是
A.可以收集到氯气![]() L
L
B.NA可表示为:![]()
C.反应后溶液中的Cl―数目为:![]()
D.反应后溶液中的H+数目为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列化学平衡在一定条件下发生移动的描述,不正确的是
A.Cl2+H2O![]() HCl+HClO,氯水中加入碳酸钙,漂白性增强
HCl+HClO,氯水中加入碳酸钙,漂白性增强
B.ZnS + Cu2+![]() CuS + Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS)
CuS + Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS)
C.2NO2![]() N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅
N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅
D.Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色) +2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深
2CrO42-(黄色) +2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图装置探究1-溴丁烷在氢氧化钠溶液中发生的反应,观察到高锰酸钾酸性溶液褪色。下列分析不正确的是
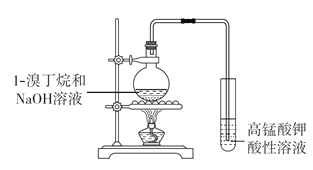
A.推断烧瓶中可能生成了1-丁醇或1-丁烯
B.用红外光谱可检验在该条件下反应生成有机物中的官能团
C.将试管中溶液改为溴水,若溴水褪色,则烧瓶中一定有消去反应发生
D.通过检验反应后烧瓶内溶液中的溴离子,可确定烧瓶内发生的反应类型
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
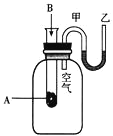
(1)该反应为________反应(填“放热”或“吸热”)。
(2)A和B的总能量比C和D的总能量_________(填“高”或“低”)。
(3)该反应的物质中的化学能通过化学反应转化成________释放出来。
(4)该反应的反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。
(5)Ⅱ、同素异形体相互转化的反应热相当小,而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成还是分几步完成,这个总过程的热效应是相同的”观点来计算反应热。
已知:
①P4(白磷,s)+5O2(g)= P4O10(s) ΔH=-2983.2 kJ·mol1
②P(红磷,s)+5/4O2(g)=1/4P4O10(s) ΔH=-738.5 kJ·mol1
则白磷转化为红磷的热化学方程式为__________。相同状况下,能量状态较低的是________;白磷的稳定性比红磷_________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g) + H2O(g) ![]() CO(g) + 3H2(g) △H=+206.0kJ·mol-1
CO(g) + 3H2(g) △H=+206.0kJ·mol-1
II:CO(g) + 2H2(g) ![]() CH3OH(g) △H=-129.0kJ·mol-1
CH3OH(g) △H=-129.0kJ·mol-1
(1)一定温度下,在容积2L且固定的两个密闭容器中,按如下方式加入反应物发生反应I,一段时间后达到平衡。
容 器 | 甲 | 乙 |
反应物投入量 | 1molCH4、1molH2O | a molCH4、a molH2O、b molCO、c molH2 |
经测定甲容器经过5min达到平衡,平衡后甲中气体的压强为开始的1.2倍,若要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则b的取值范围为__________。
(2)将1.0molCH4和2.0molH2O(g)通入容积为10L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图。
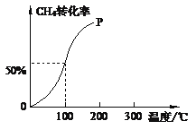
①假设100 ℃时达到平衡所需的时间为5min,则用H2表示该反应的反应速率为______。
②100℃时反应I的平衡常数为____________。
(3)若在恒温恒压容器内进行反应II,下列能说明该反应达到平衡状态的有________(填序号)。
A.有2个H—H键生成的同时有 3个C—H键断裂
B.CO百分含量保持不变
C.容器中混合气体的压强保持不变
D.容器中混合气体的密度保持不变
(4)在压强为0.1MPa、温度为300℃条件下,将amol CO与3amol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是__________(填序号)。
A.c(H2) 减少 B.正反应速率加快,逆反应速率减慢
C.n(CH3OH) 增加 D.![]() 减小 E.平衡常数K增大
减小 E.平衡常数K增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学好化学知识的重要基础,下列有关化学用语表示正确的有( )
①用电子式表示HCl的形成过程:![]()
②MgCl2的电子式:![]()
③质量数为133、中子数为78的铯原子:![]() Cs
Cs
④S2﹣的结构示意图:![]()
⑤次氯酸分子的结构式:H-O-Cl
⑥ CO2的分子比例模型示意图:![]()
A.2个B.3个C.4个D.5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
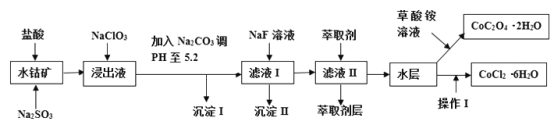
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等;②沉淀I中只含有两种沉淀;③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中Co2O3发生反应的离子反应方程式为_________________。
(2)NaClO3在浸出液中发生的离子反应方程式为______________。
(3)加入Na2CO3调PH至5.2,目的是________;萃取剂层含锰元素,则沉淀II的主要成分为_____。
(4)操作I包括:将水层加入浓盐酸调整PH为2-3,______、_____、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是_____(回答一条原因即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com