
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
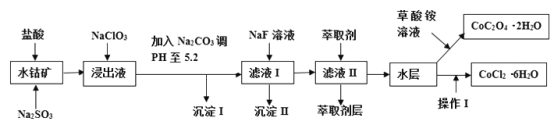
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等;②沉淀I中只含有两种沉淀;③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中Co2O3发生反应的离子反应方程式为_________________。
(2)NaClO3在浸出液中发生的离子反应方程式为______________。
(3)加入Na2CO3调PH至5.2,目的是________;萃取剂层含锰元素,则沉淀II的主要成分为_____。
(4)操作I包括:将水层加入浓盐酸调整PH为2-3,______、_____、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是_____(回答一条原因即可)。
【答案】Co2O3+SO32-+4H+= 2Co2++ SO42-+2H2O ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O 使Fe3+和Al3+沉淀完全 CaF2和MgF2 蒸发浓缩 冷却结晶 产品中结晶水含量低;产品中混有氯化钠杂质(回答一条即可)
【解析】
在盐酸和Na2SO3作用下将水钴矿中的离子浸出,得到含有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+的浸出液,NaClO3加入浸出液中,将Fe2+氧化为Fe3+,加Na2CO3调pH至5.2,目的是使Fe3+和Al3+沉淀完全转化为氢氧化铝和氢氧化铁沉淀。过滤后得到滤液Ⅰ中含有的金属阳离子为Co2+、Mn2+、Mg2+、Ca2+等,向滤液Ⅰ中加入了NaF溶液,将Mg2+、Ca2+转化为MgF2、CaF2沉淀,加盐酸调节溶液PH值,加萃取剂将锰元素从溶液中分离,经分液操作,对分离后的水层溶液加入浓盐酸调整PH为2-3,经过蒸发浓缩、冷却结晶过滤、洗涤、减压烘干等过程,最终得到所制备的产品。
(1)浸出过程中,Co2O3与盐酸、Na2SO3发生反应,Co2O3转化为Co2+,Co元素化合价降低,则S元素化合价升高,SO32-转化为SO42-,根据得失电子守恒、电荷守恒和原子守恒配平离子方程式: Co2O3+SO32-+4H+= 2Co2++ SO42-+2H2O。
答案为:Co2O3+SO32-+4H+= 2Co2++ SO42-+2H2O;
(2)NaClO3加入浸出液中,将Fe2+氧化为Fe3+,ClO3-被还原为Cl-,反应的离子方程式为: ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O。
答案为: ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;
(3)根据工艺流程图,结合表格中提供的数据可知,加Na2CO3调pH至5.2,目的是使Fe3+和Al3+沉淀完全。滤液Ⅰ中含有的金属阳离子为Co2+、Mn2+、Mg2+、Ca2+等,萃取剂层含锰元素,结合流程图中向滤液Ⅰ中加入了NaF溶液,知沉淀Ⅱ为MgF2、CaF2。
答案为:使Fe3+和Al3+沉淀完全;CaF2和MgF2
(4)经过操作Ⅰ由溶液得到结晶水合物,故除题中已知过程外,操作Ⅰ还包括蒸发浓缩、冷却结晶。
答案为:蒸发浓缩 ;冷却结晶
(5)根据CoCl2·6H2O的组成及测定过程分析,造成粗产品中CoCl2·6H2O的质量分数大于100%的原因可能是:含有氯化钠杂质,使氯离子含量增大或结晶水合物失去部分结晶水,导致相同质量的固体中氯离子含量变大。
答案为:产品中结晶水含量低;产品中混有氯化钠杂质(回答一条即可)


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 3.0g 质量分数为46%的乙醇水溶液中所含的原子数目为0.6NA
B. 23 g C2H6O分子中含C—H键数目为2.5NA
C. 0.3 mol Na2O2固体中含自由移动的离子总数为0.9NA
D. 将CO2通过Na2O2使其增重a g时,反应中转移电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出反应的化学方程式:
(1)由2-溴丙烷转化为丙烯________________;
(2)由1-溴丁烷和必要的无机试剂制取1,2-二溴丁烷_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
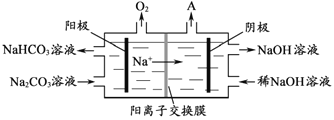
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯德榜是我国著名的工业化学家,又是一个伟大的爱国者,他所发明的制碱法为中国化学工业乃至世界化学工业做出了重要的贡献,被誉为“侯氏制碱法”。请你回答以下问题:
(1)某同学为了验证NaHCO3和Na2CO3的稳定性,设计了如图的实验装置(铁架台、夹持仪器、加热装置等已省略):
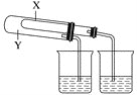
你认为在X中应放的物质是__(填化学式)。
(2)某化学研究性学习小组在老师的指导下,模拟侯德榜先生制碱原理设计了如图的实验装置。
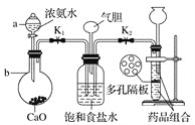
①写出有关仪器的名称:a__,b__。
②实验的操作步骤中,你认为打开旋塞K1、K2的合理顺序应为先打开__,后打开__(填字母代号)。简述理由___。
③在盛饱和食盐水的装置中发生反应的离子方程式为__;装置中气胆的作用是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
(1) N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)→2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是__________。
A.N2O分解反应中:分解速率与是否含碘蒸气有关 B.第三步对总反应速率起决定作用
C.第二步活化能比第三步小 D.IO为反应的催化剂
(2)汽车尾气中含有较多的氮氧化物和不完全燃烧的CO,汽车三元催化器可以实现降低氮氧化物的排放量。汽车尾气中的NO(g)和CO(g)在催化剂的作用下转化成两种无污染的气体。如,
反应I:2CO +2NO → N2+2CO2 △H1; 反应II:4CO +2NO2 → N2+4CO2 △H2<0。
针对反应I:①已知:反应N2(g)+O2(g)=2NO(g) △H3=+180.0kJ·mol1,若CO的燃烧热为-283.5kJ·moll 则反应I的△H1=_________kJ·mol1。
②若在恒容的密闭容器中,充入2molCO和1molNO,发生反应I,下列选项中不能说明该反应已经达到平衡状态的是_______。
A.CO和NO的物质的量之比不变 B.混合气体的密度保持不变
C.混合气体的压强保持不变 D.2v(N2)正=v(CO)逆
(3)根据原电池原理和电解原理进行如图回答。请回答: 用如图所示装置进行实验(K闭合).
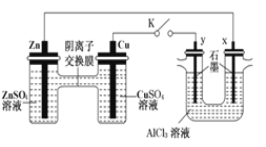
①Zn极为________极;实验过程中,SO42-________(填“从左向右”、“从右向左”或“不”)移动。
②y极的电极反应现象为________;
③写出生活中对钢闸门的一种电化学保护方法________________________。
④有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HClNH4Cl为电解质溶液制取新型燃料电池,请写出该电池的正极反应式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的检验中,其结论一定正确的是( )
A.某溶液为蓝色,则该溶液一定是CuSO4溶液
B.向某溶液中加入Ba(NO3)2溶液无明显现象,再滴入几滴硝酸酸化的AgNO3溶液,产生白色沉淀,说明原溶液中含有Cl-
C.向某溶液中加入CaCl2溶液,产生白色沉淀,则溶液中一定含有Ag+
D.加入稀HNO3酸化的BaCl2溶液,有白色沉淀生成,证明原溶液中一定有SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍钴锰酸锂电池是一种高功率动力电池。采用废旧锂离子电池回收工艺制备镍钴锰酸锂三元正极材料(铝电极表面涂有LiNi1-x-yCoxMnyO2)的工艺流程如图所示:
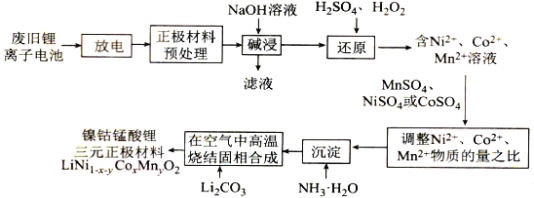
回答下列问题
(1)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极的回收,其原因是_______。
(2)能够提高“碱浸”效率的方法有______(至少写两种)。
(3)“碱浸”过程中,铝溶解的离子方程式为_____。
(4)实验室模拟“碱浸”后过滤的操作,过滤后需洗涤,简述洗涤的操作过程:_____。
(5)LiCoO2参与“还原”反应的离子方程式为_______。
(6)溶液温度和浸渍时间对钴的浸出率影响如图所示,则浸出过程的最佳条件是______。
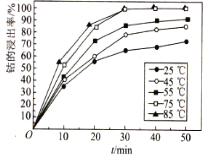
(7)已知溶液中Co2+的浓度为1.0mol·L-1,缓慢通入氨气,使其产生Co(OH)2沉淀,则Co2+沉淀完全时溶液的最小pH为______(已知:离子沉淀完全时c(Co2+)≤1.0×10-5mol·L-1,Ksp[Co(OH)2]=4.0×10-15,1g5=0.7,1g2=0.3,溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH![]() 、K+、Mg2+、Cu2+、Al3+、NO
、K+、Mg2+、Cu2+、Al3+、NO![]() 、CO
、CO![]() 、SO
、SO![]() ,现取三份100 mL溶液进行如下实验:①第一份加足量AgNO3溶液后,有白色沉淀产生。②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,以下推测不正确的是
,现取三份100 mL溶液进行如下实验:①第一份加足量AgNO3溶液后,有白色沉淀产生。②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,以下推测不正确的是

A. 原溶液一定不存在H+、Cu2+、CO![]()
B. 不能确定原溶液是否含有K+、NO![]()
C. 原溶液确定含Mg2+、Al3+、NH![]() ,且n(Mg2+) ︰ n(Al3+) ︰ n(NH
,且n(Mg2+) ︰ n(Al3+) ︰ n(NH![]() )=1︰1︰2
)=1︰1︰2
D. 实验所加的NaOH的浓度为2 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com