
【题目】镍钴锰酸锂电池是一种高功率动力电池。采用废旧锂离子电池回收工艺制备镍钴锰酸锂三元正极材料(铝电极表面涂有LiNi1-x-yCoxMnyO2)的工艺流程如图所示:
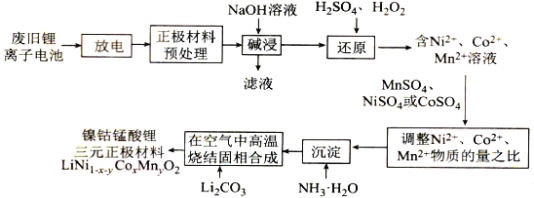
回答下列问题
(1)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极的回收,其原因是_______。
(2)能够提高“碱浸”效率的方法有______(至少写两种)。
(3)“碱浸”过程中,铝溶解的离子方程式为_____。
(4)实验室模拟“碱浸”后过滤的操作,过滤后需洗涤,简述洗涤的操作过程:_____。
(5)LiCoO2参与“还原”反应的离子方程式为_______。
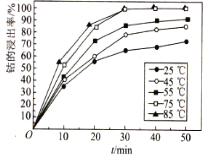
(6)溶液温度和浸渍时间对钴的浸出率影响如图所示,则浸出过程的最佳条件是______。
(7)已知溶液中Co2+的浓度为1.0mol·L-1,缓慢通入氨气,使其产生Co(OH)2沉淀,则Co2+沉淀完全时溶液的最小pH为______(已知:离子沉淀完全时c(Co2+)≤1.0×10-5mol·L-1,Ksp[Co(OH)2]=4.0×10-15,1g5=0.7,1g2=0.3,溶液体积变化忽略不计)。
【答案】放电有利于Li+向正极移动并进入正极材料 粉碎、适当增大NaOH的浓度、适当升高温度等 2Al+2H2O+2OH-=2AlO2-+3H2↑ 沿玻璃棒向过滤器中加水至浸没沉淀,待水滤出后重复操作2~3次 2LiCoO2+6H++H2O2=2Li++2Co2++4H2O+O2↑ 75℃,30 min 9.3
【解析】
(1)放电过程中,Li+向正极移动;
(2)根据影响速率的因素分析;
(3)“碱浸”过程中,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
(4)根据实验基本操作“洗涤”回答;
(5)LiCoO2参与“还原”反应中LiCoO2被H2O2还原为Co2+;
(6)根据图示,75℃,85℃,30 min 浸出率都能达到接近100%;
(7)根据Ksp[Co(OH)2]=4.0×10-15计算Co2+离子沉淀完全时c(OH-)。
(1). 放电有利于Li+向正极移动并进入正极材料,所以进行“放电处理”有利于锂在正极的回收;
(2)粉碎、适当增大NaOH的浓度、适当升高温度等,能够提高“碱浸”效率;
(3)“碱浸”过程中,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑;
(4). 洗涤的操作过程:沿玻璃棒向过滤器中加水至浸没沉淀,待水滤出后重复操作2~3次;
(5)LiCoO2参与“还原”反应中LiCoO2被H2O2还原为Co2+,反应的离子方程式是2LiCoO2+6H++H2O2=2Li++2Co2++4H2O+O2↑;
(6)根据图示,75℃和85℃,30 min 浸出率都能达到接近100%,75℃消耗能量少,所以浸出过程的最佳条件是75℃,30min;
(7)Ksp[Co(OH)2]=4.0×10-15,Co2+离子沉淀完全时c(OH-)=![]() ,c(OH-)=
,c(OH-)=![]() ,所以pH=9.3。
,所以pH=9.3。


科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是( )
A.向某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有Cl-
B.向某溶液中加BaCl2溶液生成白色沉淀,说明原溶液中有![]()
C.向某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有Cu2+
D.向某溶液中加稀硫酸生成白色沉淀,说明原溶液中有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
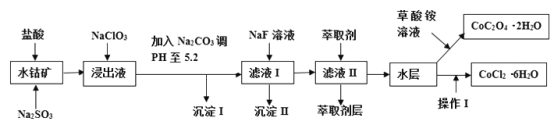
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等;②沉淀I中只含有两种沉淀;③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中Co2O3发生反应的离子反应方程式为_________________。
(2)NaClO3在浸出液中发生的离子反应方程式为______________。
(3)加入Na2CO3调PH至5.2,目的是________;萃取剂层含锰元素,则沉淀II的主要成分为_____。
(4)操作I包括:将水层加入浓盐酸调整PH为2-3,______、_____、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是_____(回答一条原因即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的现象描述与离子方程式都正确的是( )
A.金属镁与稀盐酸反应:有气泡逸出Mg+2H++2Cl-=MgCl2+H2↑
B.氯化钡溶液与稀硫酸反应:有白色沉淀生成 Ba2++SO42—=BaSO4↓
C.碳酸钠溶液与盐酸反应:有气泡逸出 Na2CO3+2H+=2Na++CO2↑+H2O
D.NaHCO3溶液中加入过量的Ba(OH)2溶液:有白色沉淀产生2HCO![]() +Ba2++2OH-===BaCO3↓+2H2O+CO32—
+Ba2++2OH-===BaCO3↓+2H2O+CO32—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的 SO2气体和 SO3气体相比较,正确的说法是
A. 密度比为 4:5 B. 物质的量之比为 4:5
C. 体积比为 1:1 D. 原子数之比为 3:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图某工厂用NO气体制取NH4NO3溶液,下列说法正确的是
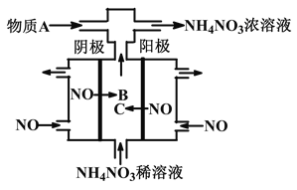
A. 阳极的电极反应式为:NO-3e-+2H2O=NO2-+4H+
B. 物质B与物质C是同一种物质
C. A物质可为氨气
D. 阴、阳两极转移的电子数之比为5∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如图所示关系,根据图示转化关系推测下列说法不正确的是

A. 可用KI淀粉试纸和食醋检验加碘盐中是否含有碘
B. 足量Cl2能使湿润的KI淀粉试纸变白的原因可能是5Cl2+I2+6H2O==2HIO3+10HCl
C. 由图可知氧化性的强弱顺序为Cl2>I2>IO3-
D. 途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解乙二醛制备乙二酸(HOOC-COOH)的装置如图所示,通电后,Pt2电极上产生的氯气将乙二醛氧化为乙二酸,下列说法正确的是

A. Pt2接电源的负极,发生还原反应
B. 盐酸的作用是提供Cl-和增强导电性
C. 电路上每转移1mol电子产生45g乙二酸
D. Pt1极上的电极反应为:2H2O-4e-=== O2↑ + 4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是( )
A.向某溶液中加入硝酸银溶液,生成白色沉淀,说明原溶液中有Cl-
B.向某溶液中加入氯化钡溶液,生成白色沉淀,说明原溶液中有![]()
C.向某溶液中加入氢氧化钠溶液,生成蓝色沉淀,说明原溶液中有Cu2+
D.向某溶液中加入盐酸后有无色气体逸出,此气体能使澄清石灰水变浑浊,可判定含有![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com