
【题目】下列离子检验的方法正确的是( )
A.向某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有Cl-
B.向某溶液中加BaCl2溶液生成白色沉淀,说明原溶液中有![]()
C.向某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有Cu2+
D.向某溶液中加稀硫酸生成白色沉淀,说明原溶液中有Ba2+
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成都需要用氯气。
I.工业上通常采用电解法制氯气:观察图1,回答:
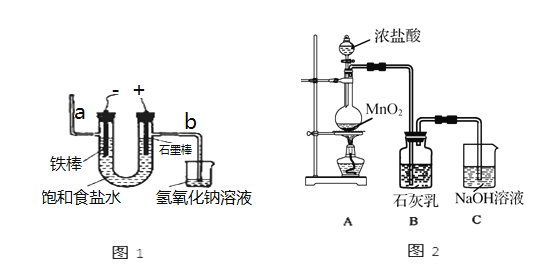
(1)电解反应的化学方程式为__________。
(2)若饱和食盐水中通电后,b侧产生的气体检验方法是___________。
Ⅱ.某兴趣小组设计如图2所示的实验装置,利用氯气与石灰乳反应制取少量漂白粉(这是一个放热反应),回答下列问题:
(3)B中反应的化学方程式是_________。
(4)该兴趣小组用100mL12mol/L盐酸与8.7g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2____g。
(5)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在装置B中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施_______。
②试判断另一个副反应(用化学方程式表示)_________,为避免此副反应的发生,可将装置做何改进_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 3.0g 质量分数为46%的乙醇水溶液中所含的原子数目为0.6NA
B. 23 g C2H6O分子中含C—H键数目为2.5NA
C. 0.3 mol Na2O2固体中含自由移动的离子总数为0.9NA
D. 将CO2通过Na2O2使其增重a g时,反应中转移电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10mL 0.40 mol·L-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 3 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是( )(溶液体积变化忽略不计)
A. 反应至6min时,H2O2分解了50%
B. 反应至6min时,c(H2O2)=0.20 mol·L-1
C. 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L·min)
D. 4~6min的平均反应速率:v(H2O2)>3.3×10-2mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】松油醇是一种调味香精,它是α、β、γ三种同分异构体组成的混合物,可由松节油分馏产品A经下列反应制得:
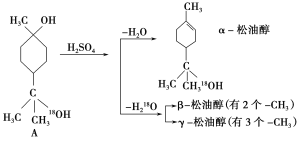
试回答:
(1)A的分子式为_____。
(2)α-松油醇能发生的反应类型是_____。
a.加成 b.水解 c.氧化
(3)写出γ-松油醇的结构简式: _________。
(4)有机物B是苧烯![]() 的同分异构体,分子结构可表示为
的同分异构体,分子结构可表示为![]() (R代表烃基),写出B可能的结构简式中的一种____。
(R代表烃基),写出B可能的结构简式中的一种____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将117 g NaCl溶于水配制成1 L溶液。
(1)该溶液中NaCl的物质的量浓度为________,溶液中Cl-的物质的量浓度为________。
(2)配制1 mol·L-1的NaCl溶液500 mL,需该溶液的体积为________。
(3)向该溶液中再通入一定量的HCl气体后,溶液中Cl-的物质的量浓度为3 mol·L-1(假设溶液体积不变),则溶液中H+的物质的量浓度为________,通入HCl气体的体积(标准状况下)为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出反应的化学方程式:
(1)由2-溴丙烷转化为丙烯________________;
(2)由1-溴丁烷和必要的无机试剂制取1,2-二溴丁烷_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。
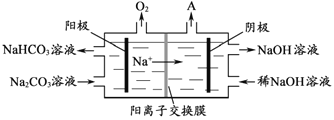
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍钴锰酸锂电池是一种高功率动力电池。采用废旧锂离子电池回收工艺制备镍钴锰酸锂三元正极材料(铝电极表面涂有LiNi1-x-yCoxMnyO2)的工艺流程如图所示:
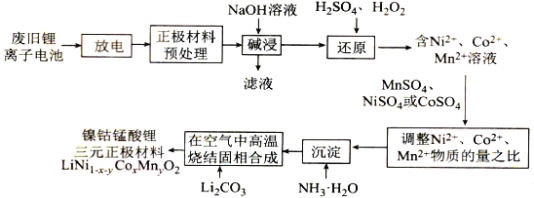
回答下列问题
(1)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极的回收,其原因是_______。
(2)能够提高“碱浸”效率的方法有______(至少写两种)。
(3)“碱浸”过程中,铝溶解的离子方程式为_____。
(4)实验室模拟“碱浸”后过滤的操作,过滤后需洗涤,简述洗涤的操作过程:_____。
(5)LiCoO2参与“还原”反应的离子方程式为_______。
(6)溶液温度和浸渍时间对钴的浸出率影响如图所示,则浸出过程的最佳条件是______。
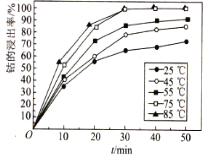
(7)已知溶液中Co2+的浓度为1.0mol·L-1,缓慢通入氨气,使其产生Co(OH)2沉淀,则Co2+沉淀完全时溶液的最小pH为______(已知:离子沉淀完全时c(Co2+)≤1.0×10-5mol·L-1,Ksp[Co(OH)2]=4.0×10-15,1g5=0.7,1g2=0.3,溶液体积变化忽略不计)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com