
【题目】按要求写出反应的化学方程式:
(1)由2-溴丙烷转化为丙烯________________;
(2)由1-溴丁烷和必要的无机试剂制取1,2-二溴丁烷_____________。
【答案】CH3-CHBr-CH3+NaOH![]() CH3-CH=CH2↑+NaBr+H2O BrCH2CH2 CH2CH3+NaOH
CH3-CH=CH2↑+NaBr+H2O BrCH2CH2 CH2CH3+NaOH![]() CH2=CHCH2CH3+NaBr+H2O、CH2=CHCH2CH3+Br2→BrCH2CHBrCH2CH3
CH2=CHCH2CH3+NaBr+H2O、CH2=CHCH2CH3+Br2→BrCH2CHBrCH2CH3
【解析】
(1)根据卤代烃在氢氧化钠的醇溶液中发生消去反应生成烯烃书写;
(2)1-溴丁烷在氢氧化钠的醇溶液中加热发生消去反应生成1-丁烯,1-丁烯与溴水发生加成反应生成1,2-二溴丁烷,据此书写反应的化学方程式。
(1)2-溴丙烷在氢氧化钠的醇溶液中发生消去反应生成丙烯,反应的化学方程式为:CH3-CHBr-CH3+NaOH![]() CH3-CH=CH2↑+NaBr+H2O,故答案为:CH3-CHBr-CH3+NaOH
CH3-CH=CH2↑+NaBr+H2O,故答案为:CH3-CHBr-CH3+NaOH![]() CH3-CH=CH2↑+NaBr+H2O;
CH3-CH=CH2↑+NaBr+H2O;
(2)1-溴丁烷在氢氧化钠的醇溶液中加热发生消去反应生成1-丁烯,反应方程式为:BrCH2CH2CH2CH3+NaOH![]() CH2=CHCH2CH3+NaBr+H2O;1-丁烯与溴水发生加成反应生成1,2-二溴丁烷,反应方程式为:CH2=CHCH2CH3+Br2→BrCH2CHBrCH2CH3,故答案为:BrCH2CH2CH2CH3+NaOH
CH2=CHCH2CH3+NaBr+H2O;1-丁烯与溴水发生加成反应生成1,2-二溴丁烷,反应方程式为:CH2=CHCH2CH3+Br2→BrCH2CHBrCH2CH3,故答案为:BrCH2CH2CH2CH3+NaOH![]() CH2=CHCH2CH3+NaBr+H2O、CH2=CHCH2CH3+Br2→BrCH2CHBrCH2CH3。
CH2=CHCH2CH3+NaBr+H2O、CH2=CHCH2CH3+Br2→BrCH2CHBrCH2CH3。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】已知:某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品1 L,进行了三组实验,其操作和有关图像如下所示:请回答下列问题:

(1)根据上述3组实验可以分析废水中一定不存在的阴离子是________,一定存在的阳离子是________。
(2)写出实验③图像中沉淀达到最大量且质量不再发生变化阶段发生反应的离子方程式________。
(3)分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为____,所得沉淀的最大质量是___g。
(4)若通过实验确定原废水中c(Na+) =0.18 mol·L-1,试判断原废水中NO3-是否存在?________(填“存在”“不存在”或“不确定”)。若存在,c(NO3-)=________ mol·L-1。(若不存在或不确定则此空不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(加试题)为应对全球石油资源日益紧缺,提高煤的利用效率,我国开发了煤制烯烃技术,并进入工业化试验阶段。
(1)煤气化制合成气(CO和H2)
已知: Ⅰ. C(s)+H2O(g)==CO(g)+H2(g) △H1=+131.3kJ·mol-1
Ⅱ. C(s)+2H2O(g)==CO2(g)+2H2(g) △H2=+90kJ·mol-1
①则CO与水蒸气反应生成CO2和H2的热化学方程式为____________。
②反应Ⅱ的△S____0(填“>”或“<”或“=”),在____情况下有利于该反应自发进行。
(2)由合成气反应可以制得甲醇,现研究由甲醇制烯烃的反应
主反应: 2CH3OH ![]() C2H4+2H2O i 3CH3OH
C2H4+2H2O i 3CH3OH ![]() C3H6+3H2O ii
C3H6+3H2O ii
副反应: 2CH3OH ![]() CH3OCH3+H2O iii
CH3OCH3+H2O iii
某实验室控制反应温度为400℃,在相同的反应体系中分别填装等量的两种催化剂(Cat.1和Cat.2),以恒定的流速通入CH3OH,在相同的压强下进行两种催化剂上甲醇制烯烃的对比研究。得到如下实验数据:(选择性:转化的甲醇中生成乙烯和丙烯的百分比)




①下列说法错误的是____________
A.反应进行一段时间后甲醇的转化率下降,可能的原因是催化剂失活,工业生产中需定期更换催化剂
B.使用Cat.2反应2h后乙烯和丙烯的选择性下降,可能的原因是生成副产物二甲醚
C.使用Cat.1产生的烯烃主要为丙烯,使用Cat.2产生的烯烃主要为乙烯
D.不管使用Cat.1还是使用Cat.2,都能提高活化分子的百分数

②在上图中分别画出反应i在无催化剂、有Cat.1、有Cat.2三种情况下“反应过程—能量”示意图_______。
(3)连续自动监测氮氧化物(NOx)的仪器动态库仑仪的工作原 理示意图如图,NiO电极上NO发生的电极反应式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是( )
A.向某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有Cl-
B.向某溶液中加BaCl2溶液生成白色沉淀,说明原溶液中有![]()
C.向某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有Cu2+
D.向某溶液中加稀硫酸生成白色沉淀,说明原溶液中有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)12.4gNa2X中含Na+0.4mol,则Na2X的摩尔质量是_____,X的相对原子质量是_____。
(2)将30mL0.5mol/L的NaOH溶液加水稀释到500mL,稀释后NaOH的物质的量浓度为_____。
(3)VL硫酸铁溶液中含有mgFe3+离子,则溶液中SO42-离子的物质的量浓度是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修5:有机化学基础]有机化合物F是一种重要的有机合成中间体,其合成路线如下图所示:

已知:①A的核磁共振氢谱图中显示两组峰②F的结构简式为:

③通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
④![]()
请回答下列问题:
(1)A的名称为______________(系统命名法);Z中所含官能团的名称是___________。
(2)反应Ⅰ的反应条件是__________;反应Ⅲ的反应类型为__________ 。
(3)E的结构简式为_______________________。
(4)写出反应Ⅴ的化学方程式____________________________________________。
(5)写出反应IV中的化学方程式____________________________________________。
(6)W是Z的同系物,相对分子质量比Z大14,则W的同分异构体中满足下列条件:
①能发生银镜反应,②苯环上有两个取代基,③不能水解,遇FeCl3溶液不显色的结构共有_________种(不包括立体异构),核磁共振氢谱有四组峰的结构为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂采用电解法处理含铬废水,利用耐酸电解槽阴阳极,槽中盛放含铬废水,原理示意如图,下列说法不正确的是( )

A.a为电源正极
B.阳极区溶液中发生的氧化还原反应为Cr2O72—+6Fe2++14H+==2Cr3++6Fe3++7H2O
C.若不考虑气体的溶解,当收集到H213.44L(标准状况)时,有0.2 molCr2O72—被还原
D.阴极区附近溶液pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
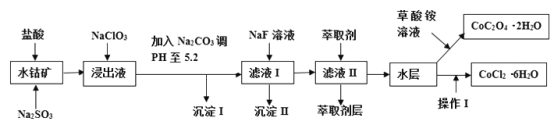
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等;②沉淀I中只含有两种沉淀;③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中Co2O3发生反应的离子反应方程式为_________________。
(2)NaClO3在浸出液中发生的离子反应方程式为______________。
(3)加入Na2CO3调PH至5.2,目的是________;萃取剂层含锰元素,则沉淀II的主要成分为_____。
(4)操作I包括:将水层加入浓盐酸调整PH为2-3,______、_____、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是_____(回答一条原因即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如图所示关系,根据图示转化关系推测下列说法不正确的是

A. 可用KI淀粉试纸和食醋检验加碘盐中是否含有碘
B. 足量Cl2能使湿润的KI淀粉试纸变白的原因可能是5Cl2+I2+6H2O==2HIO3+10HCl
C. 由图可知氧化性的强弱顺序为Cl2>I2>IO3-
D. 途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com