
【题目】某工厂采用电解法处理含铬废水,利用耐酸电解槽阴阳极,槽中盛放含铬废水,原理示意如图,下列说法不正确的是( )

A.a为电源正极
B.阳极区溶液中发生的氧化还原反应为Cr2O72—+6Fe2++14H+==2Cr3++6Fe3++7H2O
C.若不考虑气体的溶解,当收集到H213.44L(标准状况)时,有0.2 molCr2O72—被还原
D.阴极区附近溶液pH增大
【答案】C
【解析】
A.由图可知,右侧生成氢气,发生还原反应,右侧铁板为阴极,故左侧铁板为阳极,故a为电源正极,A项正确;
B.左侧铁板为阳极,铁放电生成亚铁离子,亚铁离子被溶液中的Cr2O72-氧化,反应生成Cr3+、Fe3+,发应的离子方程式为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,B项正确;
C.13.44L氢气的物质的量为![]() =0.6mol,根据电子转移守恒n(Fe2+)=
=0.6mol,根据电子转移守恒n(Fe2+)=![]() =0.6mol,根据Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O可知,被还原的Cr2O72-的物质的量为0.6mol×
=0.6mol,根据Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O可知,被还原的Cr2O72-的物质的量为0.6mol×![]() =0.1mol,C项错误;
=0.1mol,C项错误;
D. 阴极氢离子放电生成氢气,氢离子浓度降低,溶液的pH增大,D项正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】(1)3.1g Na2X含有Na+ 0.1mol,则Na2X的摩尔质量为__,X的相对原子质量为__。
(2)同温同压下,同体积的甲烷和氢气分子数之比为__,原子个数之比为__,质量之比为__,电子数之比为___。
(3)现有下列物质:
①CO2 ②液态氯化氢 ③CH4 ④熔融NaOH ⑤NH4Cl固体 ⑥氨水
请用序号回答下列问题:能导电的是___。属于电解质的是___。属于非电解质的是___。
(4)K2SO4和Fe2(SO4)3的混合溶液,已知其中Fe3+的浓度为0.5mol/L,SO42-浓度为0.9mol/L,则K+的物质的量浓度为___mol/L;简述混合液中阴离子的检验方法:___。
(5)在标准状况下,将V L NH3溶于0.1L水中,所得溶液的密度为d g/cm3,则所得溶液的物质的量浓度为___mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】松油醇是一种调味香精,它是α、β、γ三种同分异构体组成的混合物,可由松节油分馏产品A经下列反应制得:
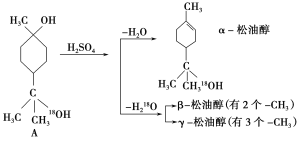
试回答:
(1)A的分子式为_____。
(2)α-松油醇能发生的反应类型是_____。
a.加成 b.水解 c.氧化
(3)写出γ-松油醇的结构简式: _________。
(4)有机物B是苧烯![]() 的同分异构体,分子结构可表示为
的同分异构体,分子结构可表示为![]() (R代表烃基),写出B可能的结构简式中的一种____。
(R代表烃基),写出B可能的结构简式中的一种____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出反应的化学方程式:
(1)由2-溴丙烷转化为丙烯________________;
(2)由1-溴丁烷和必要的无机试剂制取1,2-二溴丁烷_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是( )
A. 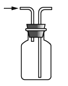 收集 NOB.
收集 NOB.  制备 NH3
制备 NH3
C.  制备 Fe(OH)2D.
制备 Fe(OH)2D. 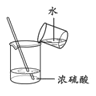 稀释浓 H2SO4
稀释浓 H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。
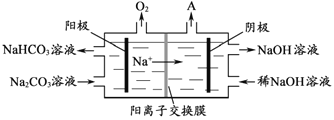
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯德榜是我国著名的工业化学家,又是一个伟大的爱国者,他所发明的制碱法为中国化学工业乃至世界化学工业做出了重要的贡献,被誉为“侯氏制碱法”。请你回答以下问题:
(1)某同学为了验证NaHCO3和Na2CO3的稳定性,设计了如图的实验装置(铁架台、夹持仪器、加热装置等已省略):
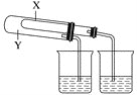
你认为在X中应放的物质是__(填化学式)。
(2)某化学研究性学习小组在老师的指导下,模拟侯德榜先生制碱原理设计了如图的实验装置。
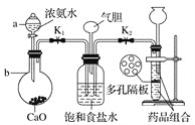
①写出有关仪器的名称:a__,b__。
②实验的操作步骤中,你认为打开旋塞K1、K2的合理顺序应为先打开__,后打开__(填字母代号)。简述理由___。
③在盛饱和食盐水的装置中发生反应的离子方程式为__;装置中气胆的作用是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的检验中,其结论一定正确的是( )
A.某溶液为蓝色,则该溶液一定是CuSO4溶液
B.向某溶液中加入Ba(NO3)2溶液无明显现象,再滴入几滴硝酸酸化的AgNO3溶液,产生白色沉淀,说明原溶液中含有Cl-
C.向某溶液中加入CaCl2溶液,产生白色沉淀,则溶液中一定含有Ag+
D.加入稀HNO3酸化的BaCl2溶液,有白色沉淀生成,证明原溶液中一定有SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据物质结构有关性质和特点,回答下列问题:
(1)基态As原子的价层电子的电子云轮廓图形状为_____________。
(2)Na3AsO3可用于碘的微量分析。Na3AsO3中所含阴离子的立体构型为_____________,写出一种与其互为等电子体的分子:_____________(填化学式)。
(3)丙烯腈(CH2=CH-CN)分子中碳原子轨道杂化类型是____________。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为___________。区分晶体Ni和非晶体Ni的最可靠的科学方法为___________。
(5)钛存在两种同素异形体,α—Ti采纳六方最密堆积,β—Ti采纳体心立方堆积,由α—Ti转变为β—Ti晶体体积____________(填“膨胀”或“收缩”)。
(6)某镍白铜合金的立方晶胞结构如图所示。若合金的密度为d g·cm-3,晶胞参数a=______ nm。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com