
����Ŀ����°����ҹ������Ĺ�ҵ��ѧ�ң�����һ��ΰ��İ����ߣ������������ƼΪ�й���ѧ��ҵ�������绯ѧ��ҵ��������Ҫ�Ĺ��ף�����Ϊ�������Ƽ��������ش��������⣺
��1��ijͬѧΪ����֤NaHCO3��Na2CO3���ȶ��ԣ��������ͼ��ʵ��װ��(����̨���г�����������װ�õ���ʡ��)��
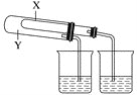
����Ϊ��X��Ӧ�ŵ�������__(�ѧʽ)��
��2��ij��ѧ�о���ѧϰС������ʦ��ָ���£�ģ���°������Ƽ�ԭ���������ͼ��ʵ��װ�á�
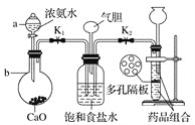
��д���й����������ƣ�a__��b__��
��ʵ��IJ��������У�����Ϊ������K1��K2�ĺ���˳��ӦΪ�ȴ�__�����__(����ĸ����)����������___��
����ʢ����ʳ��ˮ��װ���з�����Ӧ�����ӷ���ʽΪ__��װ����������������__��
���𰸡�NaHCO3 ��Һ©�� Բ����ƿ K1 K2 ������ˮ���ܽ�Ⱥܴ�(1��700)����ͨ�����������ڶ�����̼�ij�����գ�������Ƽ��Ч�� Na����NH3��CO2��H2O=NaHCO3����NH4+ ƽ��װ������ѹǿ���洢ʣ������
��������
�����Ƽ�����������Ȼ�����Һ��ͨ�백������ͨ��CO2����̼�����Ƶ��ܽ�ȱ�̼����С����̼�����Ƴ������ɣ�������ϴ�Ӹ�����ٽ�̼�����Ƽ��ȷֽ�ɵô��ͬʱ���ɵ�CO2ѭ�����á�
��1��̼���Ʊ�̼�������ȶ�����ѡ���Ӽ��ȵķ������Ƚ������ε��ȶ��ԣ�
��2���ٸ���ʵ��װ���ж��������ƣ�
�ں����Ƽ��ԭ������ͨ��������ͨCO2�����ð�������ˮ�γɼ�����Һ����������CO2���ܽ⣻
�۱���ʳ��ˮ����ͨ��������ͨCO2���������ܽ�ȸ�С��̼�����ƣ���Ӧ����ʽΪNaCl��NH3��CO2��H2O=NaHCO3����NH4Cl���ݴ˻ش����⡣
��1��Y��ֱ�Ӽ��ȵĹ��壬��ѡ��̼���ƣ�X�Ǽ�Ӽ��ȵĹ��壬Ϊ̼�����ƣ�����ʵ��ʱֱ�Ӽ��ȵ�̼���Ʋ��ֽ⣬��Ӽ��ȵ�̼�����Ʒ����ֽ⣬��֪̼���Ʊ�̼�������ȶ���
��2����aΪ��Һ©����bΪԲ����ƿ��
�ں����Ƽ��ԭ������ͨ��������ͨCO2������Ӧ�ȴ�K1���ٴ�K2��ԭ���ǰ�������ˮ�γɼ�����Һ����������CO2���ܽ⣬������Ƽ��Ч�ʣ�
�۱���ʳ��ˮ����ͨ��������ͨCO2���������ܽ�ȸ�С��̼�����ƣ���Ӧ����ʽΪNaCl��NH3��CO2��H2O=NaHCO3����NH4Cl�����ӷ���ʽΪNa����NH3��CO2��H2O=NaHCO3����NH4+��װ����������������ƽ������ѹǿ���洢ʣ�����塣


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ�����ӵ�����������˵����ȷ����
A. CO��Ħ������Ϊ28g
B. 1mol��L-1 NaOH��Һ��������Na+��ĿΪNA
C. 8g NH4NO3�к���0.2mol Nԭ��
D. 0.5mol H2��ռ�����ԼΪ11.2L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��12.4gNa2X�к�Na+0.4mol����Na2X��Ħ��������_____��X�����ԭ��������_____��
��2����30mL0.5mol/L��NaOH��Һ��ˮϡ�͵�500mL��ϡ�ͺ�NaOH�����ʵ���Ũ��Ϊ_____��
��3��VL��������Һ�к���mgFe3+���ӣ�����Һ��SO42-���ӵ����ʵ���Ũ����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������õ�ⷨ����������ˮ�������������������������ʢ�ź�����ˮ��ԭ��ʾ����ͼ������˵������ȷ���ǣ� ��

A.aΪ��Դ����
B.��������Һ�з�����������ԭ��ӦΪCr2O72��+6Fe2++14H+==2Cr3++6Fe3++7H2O
C.��������������ܽ⣬���ռ���H213.44L(��״��)ʱ����0.2 molCr2O72������ԭ
D.������������ҺpH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��ȷ���ǣ� ��
A. ���������Һ��ͨ������Ķ�����̼ Ca2++2ClO��+H2O+CO2�TCaCO3��+2HClO
B. Ba(HCO3)2��Һ��������NaOH��Һ��Ӧ��Ba2����HCO![]() ��OH��==BaCO3����H2O
��OH��==BaCO3����H2O
C. �ð�ˮ���������������� OH��+SO2�THSO3��
D. ����������������Һ��Ӧ��Ba2����SO42-==BaSO4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ�ܿ���Ҫ�ɷ�ΪCo2O3��������Fe2O3��A12O3��MnO��MgO��CaO��SiO2�ȣ�������ȡ���ֻ����Լ�������Ϊ�����ܾ�����Ȼ��ܾ�����Ʊ����̣��ش��������⣺
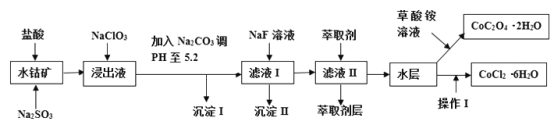
��֪���ٽ���Һ�к��е���������Ҫ��H+��Co2+��Fe2+��Mn2+��Al3+��Mg2+��Ca2+�ȣ��ڳ���I��ֻ�������ֳ������������в���������������������ʽ����ʱ��Һ��pH���±���
������ | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
��ʼ���� | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
��ȫ���� | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
��1������������Co2O3������Ӧ�����ӷ�Ӧ����ʽΪ_________________��
��2��NaClO3�ڽ���Һ�з��������ӷ�Ӧ����ʽΪ______________��
��3������Na2CO3��PH��5.2��Ŀ����________����ȡ���㺬��Ԫ�أ������II����Ҫ�ɷ�Ϊ_____��
��4������I��������ˮ�����Ũ�������PHΪ2-3��______��_____�����ˡ�ϴ�ӡ���ѹ��ɵȹ��̡�
��5��Ϊ�ⶨ�ֲ�Ʒ��CoCl2��6H2O��������ȡһ�������Ĵֲ�Ʒ����ˮ���������������ữ����������Һ�����ˡ�ϴ�ӡ���������������ͨ�����㷢�ֲִ�Ʒ��CoCl2��6H2O������������100%,��ԭ�������_____���ش�һ��ԭ�ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ܡ������仯������������;���ش��������⣺
��1����̬��ԭ�Ӻ����____________�ֲ�ͬ�ռ��˶�״̬�ĵ��ӣ������ܡ�����̬ԭ�Ӻ���δ�ɶԵ��������ٵļ۲���ӵĵ����Ų�ͼ���������ʽ��Ϊ_________________��
��2��̪ݼ�ܷ��ӵĽṹ��ʽ��ͼ��ʾ������������ԭ��ͨ����λ����ϵĵ�ԭ�ӵı����______������1����2����3������4���������������ַǽ���ԭ�ӵĵ縺���ɴ�С��˳��Ϊ____________������Ӧ��Ԫ�ط��ű�ʾ����������̼ԭ�ӵ��ӻ��������Ϊ____________��
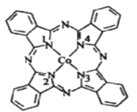
��3��������أ�K2FeO4����һ�����͡���Ч�������ɫˮ���������þ����̬�²����磬����״̬��ˮ��Һ���ܵ��磬�þ�������____��������ͣ��������Fe��CO��x������ԭ�Ӽ۵������������ṩ������֮��Ϊ16����x=___��
��4��NiO��FeO�ľ���ṹ�������Ȼ��Ƶ���ͬ��Ni2+��Fe2+�����Ӱ뾶�ֱ�Ϊ69pm��74pm�����۵�NiO____FeO��������������������=������ԭ����______��
��5��Ni��O��Cr�����γ�һ�־���������Եĸ�������������ṹ��ͼ��ʾ�������߳�Ϊapm�������ӵ�������ֵΪNA���侧���ܶȵļ������ʽΪ_______g��cm-3.��
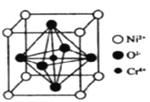
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ��ͬѹ��,�������� SO2����� SO3������Ƚ�,��ȷ��˵����
A. �ܶȱ�Ϊ 4:5 B. ���ʵ���֮��Ϊ 4:5
C. �����Ϊ 1:1 D. ԭ����֮��Ϊ 3:4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Դ�������ȷ������Ź㷺����;��������أ�K2FeO4��������һ�������ˮ�����������Ҹ�����ص�����Ҳ�ڽ����С���ͼ1�Ǹ�����ص�ģ��ʵ��װ�ã�

��1���õ�طŵ�ʱ�����ĵ缫��ӦʽΪ_________________����ά�ֵ���ǿ��ΪlA����ع���10 min����������Zn______g����֪F��965OOC/mol��������С�������һλ���֣���
��2��������ʢ�б���KCl��Һ������������������______����������������������ͬ�����ƶ������������ӽ���Ĥ�������ţ����������______�ƶ���
��3��ͼ2Ϊ������غͳ��õĸ��ܼ��Ե�صķŵ����ߣ��ɴ˿ɵó�������ص��ŵ���______________��

��������϶������������õ綯������ȼ������߽���ƶ��������������»����ʱ���綯���ṩ�ƶ������������͵����ģ���ɲ��������ʱ����ش��ڳ��״̬��
��4����϶���������ȼ��������Ϊȼ�ϣ����ͣ�������C8H18�ƣ���������ַ�Ӧ������1 mol ˮ��������550kJ����1 gˮ����ת��ΪҺ̬ˮ����2.5kJ��������ȼ���ȵ��Ȼ�ѧ����ʽΪ_____________��
��5����϶�����Ŀǰһ��ʹ�������أ��õ�������Ļ�����Ϊ�����������������M��ʾ��Ϊ��������Һ����ҪΪKOH��Ϊ�������Һ�������س�ŵ�ԭ��ʾ����ͼ�����ܷ�ӦʽΪ��
H2+2NiOOH![]() 2Ni(OH)2��
2Ni(OH)2��
����������Ϣ�жϣ���϶��������»����ʱ���ҵ缫��Χ��Һ��pH______������������,����С�����������������õ缫�ĵ缫��ӦʽΪ_______________��

��6��Զ���ִ��ĸ��������ں�ˮ�������绯ѧ��ʴ�е�______��ʴ��������ͼװ�ã�����ģ�����ĵ绯ѧ������

��XΪ̼����Ϊ�������ĸ�ʴ������KӦ����______����
��XΪп������K����M�����õ绯ѧ��������Ϊ_______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com