
【题目】Ⅰ.高铁酸盐在能源,环保等方面有着广泛的用途。高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1是高铁电池的模拟实验装置:

(1)该电池放电时正极的电极反应式为_________________;若维持电流强度为lA,电池工作10 min,理论消耗Zn______g(己知F=965OOC/mol,计算结果小数点后保留一位数字)。
(2)盐桥中盛有饱和KCl溶液,此盐桥中氯离子向______(填“左”或“右”,下同)池移动;若用阳离子交换膜代替盐桥,则钾离子向______移动。
(3)图2为高铁电池和常用的高能碱性电池的放电曲线.由此可得出高铁电地的优点有______________。

Ⅱ.第三代混合动力车,可以用电动机,内燃机或二者结合推动车辆。汽车上坡或加速时,电动机提供推动力.降低汽油的消耗;在刹车或下坡时,电池处于充电状态。
(4)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,生成1 mol 水蒸气放热550kJ;若1 g水蒸气转化为液态水放热2.5kJ,则辛烷燃烧热的热化学方程式为_____________。
(5)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理示意如图,其总反应式为:
H2+2NiOOH![]() 2Ni(OH)2。
2Ni(OH)2。
根据所给信息判断,混合动力车上坡或加速时.乙电极周围溶液的pH______(填“增大”,“减小”或“不变”),该电极的电极反应式为_______________。

(6)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的______腐蚀。利用如图装置,可以模拟铁的电化学防护。

若X为碳棒,为减缓铁的腐蚀,开关K应置于______处。
若X为锌,开关K置于M处,该电化学防护法称为_______。
【答案】FeO42-+4H2O+3e-=Fe(OH)3+5OH- 0.2 右 左 使用时间长、工作电压稳定 C8H18(l) + ![]() O2(g)=8CO2(g)+9H2O(l) △H=-5355kJ/mol 增大 NiOOH+H2O+e-=Ni(OH)2+OH- 吸氧 N 牺牲阳极的阴极保护法。
O2(g)=8CO2(g)+9H2O(l) △H=-5355kJ/mol 增大 NiOOH+H2O+e-=Ni(OH)2+OH- 吸氧 N 牺牲阳极的阴极保护法。
【解析】
(1)根据电池装置,Zn做负极,C为正极;根据电子转移计算Zn的质量;
(2)原电池中,阳离子向正极移动,阴离子向负极移动;
(4)注意燃烧热指1mol可燃物完全燃烧生成稳定的氧化物(如液态水);
(5)混合动力车上坡或加速时,电池处于放电状态即原电池的工作原理;
(6)紧扣牺牲阳极的保护法和外加电流的阴极保护法原理答题即可。
(1)C为正极,高铁酸钾的氧化性很强,正极上高铁酸钾发生还原反应生成Fe(OH)3,正极电极反应式为:FeO42-+4H2O+3e-═Fe(OH)3↓+5OH-,若维持电流强度为1A,电池工作十分钟,通过电子为![]() ,则理论消耗Zn为
,则理论消耗Zn为![]() ×
×![]() ×65g/mol=0.2g;
×65g/mol=0.2g;
(2)盐桥中阴离子移向负极移动,盐桥起的作用是使两个半电池连成一个通路,使两溶液保持电中性,起到平衡电荷,构成闭合回路,放电时盐桥中氯离子向右移动,用阳离子交换膜代替盐桥,阳离子向正极移动,则钾离子向左移动;
(3)由图可知高铁电池的优点有:使用时间长、工作电压稳定;
(4)辛烷燃烧生成1mol水蒸气放热550kJ,所以生成9mol水蒸气放热4950kJ,1 g水蒸气(即![]() mol)转化为液态水放热2.5kJ,9mol水蒸气转化为液态水放热405kJ,综上,辛烷的燃烧热为5355kJ/mol。则辛烷燃烧热的热化学方程式为C8H18(l) +
mol)转化为液态水放热2.5kJ,9mol水蒸气转化为液态水放热405kJ,综上,辛烷的燃烧热为5355kJ/mol。则辛烷燃烧热的热化学方程式为C8H18(l) + ![]() O2(g)=8CO2(g)+9H2O(l) △H=-5355kJ/mol;
O2(g)=8CO2(g)+9H2O(l) △H=-5355kJ/mol;
(5)H2+2NiOOH![]() 2Ni(OH)2,混合动力车上坡或加速时,电池处于放电状态即原电池的工作原理,乙电极是正极,是NiOOH转化为氢氧化镍的过程,该电极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-,故碱性增强,乙电极周围溶液的pH增大;
2Ni(OH)2,混合动力车上坡或加速时,电池处于放电状态即原电池的工作原理,乙电极是正极,是NiOOH转化为氢氧化镍的过程,该电极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-,故碱性增强,乙电极周围溶液的pH增大;
(6)水膜呈中性或者酸性较弱时发生吸氧腐蚀,海水中发生的是吸氧腐蚀。在电解池中,阴极是被保护的电极,可以把船体与电源的负极相连,作阴极被保护,则若X为碳棒,为减缓铁的腐蚀,开关K应置于N处。在原电池中,活泼性较差的电极一般为正极,正极被保护,若X为锌,开关K置于M处,该电化学防护法称为牺牲阳极的阴极保护法。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】侯德榜是我国著名的工业化学家,又是一个伟大的爱国者,他所发明的制碱法为中国化学工业乃至世界化学工业做出了重要的贡献,被誉为“侯氏制碱法”。请你回答以下问题:
(1)某同学为了验证NaHCO3和Na2CO3的稳定性,设计了如图的实验装置(铁架台、夹持仪器、加热装置等已省略):
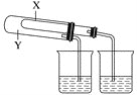
你认为在X中应放的物质是__(填化学式)。
(2)某化学研究性学习小组在老师的指导下,模拟侯德榜先生制碱原理设计了如图的实验装置。
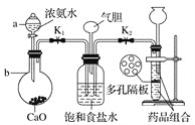
①写出有关仪器的名称:a__,b__。
②实验的操作步骤中,你认为打开旋塞K1、K2的合理顺序应为先打开__,后打开__(填字母代号)。简述理由___。
③在盛饱和食盐水的装置中发生反应的离子方程式为__;装置中气胆的作用是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是向MgCl2、AlCl3混合溶液中,开始滴加7mL试剂A,之后改滴试剂B,所得沉淀y(mol)与试剂体积V(mL)间的关系.以下结论不正确的是( )

A. A是NaOH,B是盐酸,且c(NaOH)︰c(HCl)=2︰1
B. 原混合液中,c(Al3+)︰c(Mg2+)︰c(Cl-)=1︰1︰5
C. A是NaOH,B是盐酸,且c(NaOH)︰c(HCl)=1︰2
D. 从6到9,相应离子反应式H+ + OH-===H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据物质结构有关性质和特点,回答下列问题:
(1)基态As原子的价层电子的电子云轮廓图形状为_____________。
(2)Na3AsO3可用于碘的微量分析。Na3AsO3中所含阴离子的立体构型为_____________,写出一种与其互为等电子体的分子:_____________(填化学式)。
(3)丙烯腈(CH2=CH-CN)分子中碳原子轨道杂化类型是____________。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为___________。区分晶体Ni和非晶体Ni的最可靠的科学方法为___________。
(5)钛存在两种同素异形体,α—Ti采纳六方最密堆积,β—Ti采纳体心立方堆积,由α—Ti转变为β—Ti晶体体积____________(填“膨胀”或“收缩”)。
(6)某镍白铜合金的立方晶胞结构如图所示。若合金的密度为d g·cm-3,晶胞参数a=______ nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置关系如图所示。下列判断正确的是
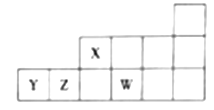
A. 原子半径:rW>rZ>rY>rX
B. 最高价氧化物对应水化物的酸性:Z>X>Y
C. X、Z、W形成的简单氢化物中X的氢化物沸点最高
D. W与Y元素形成的化合物在水溶液中能稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH![]() 、K+、Mg2+、Cu2+、Al3+、NO
、K+、Mg2+、Cu2+、Al3+、NO![]() 、CO
、CO![]() 、SO
、SO![]() ,现取三份100 mL溶液进行如下实验:①第一份加足量AgNO3溶液后,有白色沉淀产生。②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,以下推测不正确的是
,现取三份100 mL溶液进行如下实验:①第一份加足量AgNO3溶液后,有白色沉淀产生。②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,以下推测不正确的是

A. 原溶液一定不存在H+、Cu2+、CO![]()
B. 不能确定原溶液是否含有K+、NO![]()
C. 原溶液确定含Mg2+、Al3+、NH![]() ,且n(Mg2+) ︰ n(Al3+) ︰ n(NH
,且n(Mg2+) ︰ n(Al3+) ︰ n(NH![]() )=1︰1︰2
)=1︰1︰2
D. 实验所加的NaOH的浓度为2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是生活中常见的金属,请回答下列问题:
(1)Cu不活泼,通常情况下不与稀硫酸反应,但向Cu和稀硫酸的混合物中滴入H2O2溶液后,溶液很快变蓝色,试写出该反应的离子方程式_____________________________________________________________。
(2)将硫酸铜溶液和碳酸钠溶液混合,会析出Cu2(OH)2CO3绿色固体,试写出该反应的离子方程式________________________________。
(3)火法炼铜的原理:Cu2S+O2高温,2Cu+SO2,在该反应中每生成1 mol Cu,转移________mol e-。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是________(填选项字母)。
a.粗铜接电源正极,发生氧化反应
b.溶液中Cu2+向阴极移动
c.电解过程中,阳极和阴极的质量变化相等
d.利用阳极泥可回收Al、Zn等金属
(5)据报道,有一种叫Thibacillus Ferroxidans的细菌在有氧气存在的酸性溶液中,可将黄铜矿中CuFeS2氧化成硫酸盐:4CuFeS2+2H2SO4+17O2===4CuSO4+2Fe2(SO4)3+2H2O。利用反应后的溶液,按如下流程可制备胆矾(CuSO4·5H2O):
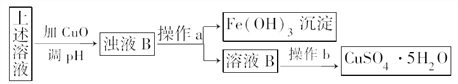
①检验溶液B中Fe3+是否被除尽的实验方法___________________________________________。
②在实验室中,设计两个原理不同的方案,从溶液B中提炼金属铜(要求:一种方案只用一个反应来完成)。写出两种方案中涉及的化学方程式
方案一:___________________________________________;
方案二:______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Cu、Fe2O3的混合物中加入400 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+。若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为
A. 2.4 g B. 3.2 g C. 4.8 g D. 6.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,已知两瓶容积相同,同温同压下,左瓶内充满氯化氢气体,当右瓶中充满下列混合气体中的某一组时,其所含原子总数与左瓶中所含原子总数一定相等,则该混合气体是( )

A. O3、N2 B. CH4、NH3 C. N2、O2 D. CO、CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com