
【题目】(加试题)为应对全球石油资源日益紧缺,提高煤的利用效率,我国开发了煤制烯烃技术,并进入工业化试验阶段。
(1)煤气化制合成气(CO和H2)
已知: Ⅰ. C(s)+H2O(g)==CO(g)+H2(g) △H1=+131.3kJ·mol-1
Ⅱ. C(s)+2H2O(g)==CO2(g)+2H2(g) △H2=+90kJ·mol-1
①则CO与水蒸气反应生成CO2和H2的热化学方程式为____________。
②反应Ⅱ的△S____0(填“>”或“<”或“=”),在____情况下有利于该反应自发进行。
(2)由合成气反应可以制得甲醇,现研究由甲醇制烯烃的反应
主反应: 2CH3OH ![]() C2H4+2H2O i 3CH3OH
C2H4+2H2O i 3CH3OH ![]() C3H6+3H2O ii
C3H6+3H2O ii
副反应: 2CH3OH ![]() CH3OCH3+H2O iii
CH3OCH3+H2O iii
某实验室控制反应温度为400℃,在相同的反应体系中分别填装等量的两种催化剂(Cat.1和Cat.2),以恒定的流速通入CH3OH,在相同的压强下进行两种催化剂上甲醇制烯烃的对比研究。得到如下实验数据:(选择性:转化的甲醇中生成乙烯和丙烯的百分比)




①下列说法错误的是____________
A.反应进行一段时间后甲醇的转化率下降,可能的原因是催化剂失活,工业生产中需定期更换催化剂
B.使用Cat.2反应2h后乙烯和丙烯的选择性下降,可能的原因是生成副产物二甲醚
C.使用Cat.1产生的烯烃主要为丙烯,使用Cat.2产生的烯烃主要为乙烯
D.不管使用Cat.1还是使用Cat.2,都能提高活化分子的百分数

②在上图中分别画出反应i在无催化剂、有Cat.1、有Cat.2三种情况下“反应过程—能量”示意图_______。
(3)连续自动监测氮氧化物(NOx)的仪器动态库仑仪的工作原 理示意图如图,NiO电极上NO发生的电极反应式:_______。
【答案】CO(g)+ H2O(g)==CO2(g)+H2(g) △H =-41.3kJmol-1 > 高温 C 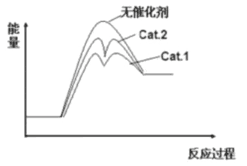 NO+ O2 --2e-= NO2
NO+ O2 --2e-= NO2
【解析】
(1)①.根据盖斯定律,用②-①,即可解得。
②反应Ⅱ的混乱度增大,故△S>0,根据△H-T△S<0为自发反应,判断出在高温下有利于该反应自发进行。
(2)①A. 温度过高,催化剂失去活性,所以工业生产中需定期更换催化剂。
B.由题意可知,甲醇制烯烃的反应中发生副反应: 2CH3OH CH3OCH3+H2O,所以使用Cat.2反应2h后乙烯和丙烯的选择性下降,可能的原因是生成副产物二甲醚。
C.由 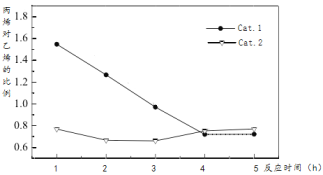 图可知,小于3小时主要生成丙烯,大于3小时主要生成乙烯。
图可知,小于3小时主要生成丙烯,大于3小时主要生成乙烯。
D.催化剂是通过降低反应所需的活化能来增大反应速率的,催化剂使更多的反应物分子成为活化分子。
②反应i在无催化剂、有Cat.1、有Cat.2三种情况下“反应过程—能量”示意图为:
 。
。
(3)NO失电子,发生氧化反应,NiO电极上发生的电极反应式:NO+ O2 --2e-= NO2。
(1)Ⅰ. C(s)+H2O(g)==CO(g)+H2(g) △H1=+131.3kJ·mol-1①
Ⅱ. C(s)+2H2O(g)==CO2(g)+2H2(g) △H2=+90kJ·mol-1②
①.根据盖斯定律,用②-①,得到CO(g)+ H2O(g)==CO2(g)+H2(g) △H =-41.3kJmol-1,故答案为:CO(g)+ H2O(g)==CO2(g)+H2(g) △H =-41.3kJmol-1。
②反应Ⅱ的混乱度增大,故△S>0,根据△H-T△S<0为自发反应,判断出在高温下有利于该反应自发进行,故答案为:>;高温。
(2)①A. 温度过高,催化剂失去活性,所以工业生产中需定期更换催化剂,故A正确;
B.由题意可知,甲醇制烯烃的反应中发生副反应: 2CH3OH CH3OCH3+H2O,所以使用Cat.2反应2h后乙烯和丙烯的选择性下降,可能的原因是生成副产物二甲醚,故B正确;
C.由  图可知,小于3小时主要生成丙烯,大于3小时主要生成乙烯,故C错误;
图可知,小于3小时主要生成丙烯,大于3小时主要生成乙烯,故C错误;
D.催化剂是通过降低反应所需的活化能来增大反应速率的,催化剂使更多的反应物分子成为活化分子,故D正确;
故选C。
②反应i在无催化剂、有Cat.1、有Cat.2三种情况下“反应过程—能量”示意图为:

故答案为: 。
。
(3)NO失电子,发生氧化反应,NiO电极上发生的电极反应式:NO+ O2 --2e-= NO2,故答案为:NO+ O2 --2e-= NO2。


科目:高中化学 来源: 题型:
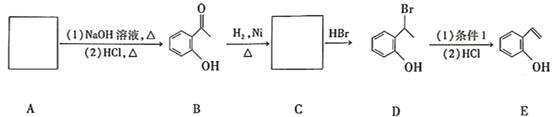
【题目】现有如下有机化合物的转化路线:
已知: +CO2
+CO2
(1)D中的官能团名称是____________________。
(2)D转化为E时的“反应条件1”是_______________________。
(3)C的结构简式是_________________________,化合物C转化为D时的反应类型是______________。
(4)D 的分子式为____________________。
(5)E 与足量的浓溴水反应,相关化学方程式为_______________________________。
(6)酯类物质A的分子式为C9H6O3,A的结构简式是________________________。
(7)化合物A符合如下条件的同分异构体有_____________种。
①除苯环外无其他环状结构
②能与FeCl3溶液发生显色反应
③能与NaHCO3溶液反应产生 CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)3.1g Na2X含有Na+ 0.1mol,则Na2X的摩尔质量为__,X的相对原子质量为__。
(2)同温同压下,同体积的甲烷和氢气分子数之比为__,原子个数之比为__,质量之比为__,电子数之比为___。
(3)现有下列物质:
①CO2 ②液态氯化氢 ③CH4 ④熔融NaOH ⑤NH4Cl固体 ⑥氨水
请用序号回答下列问题:能导电的是___。属于电解质的是___。属于非电解质的是___。
(4)K2SO4和Fe2(SO4)3的混合溶液,已知其中Fe3+的浓度为0.5mol/L,SO42-浓度为0.9mol/L,则K+的物质的量浓度为___mol/L;简述混合液中阴离子的检验方法:___。
(5)在标准状况下,将V L NH3溶于0.1L水中,所得溶液的密度为d g/cm3,则所得溶液的物质的量浓度为___mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 3.0g 质量分数为46%的乙醇水溶液中所含的原子数目为0.6NA
B. 23 g C2H6O分子中含C—H键数目为2.5NA
C. 0.3 mol Na2O2固体中含自由移动的离子总数为0.9NA
D. 将CO2通过Na2O2使其增重a g时,反应中转移电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子结构中各种化学键如图所示,关于乙醇在各种反应中断键的说明不正确的
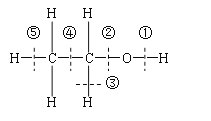
A.和金属钠反应是键①断裂
B.和浓氢溴酸混合加热时断键②
C.和浓硫酸共热到170℃时断键②和⑤
D.和浓硫酸共热到140℃时仅断键②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10mL 0.40 mol·L-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 3 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是( )(溶液体积变化忽略不计)
A. 反应至6min时,H2O2分解了50%
B. 反应至6min时,c(H2O2)=0.20 mol·L-1
C. 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L·min)
D. 4~6min的平均反应速率:v(H2O2)>3.3×10-2mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】松油醇是一种调味香精,它是α、β、γ三种同分异构体组成的混合物,可由松节油分馏产品A经下列反应制得:
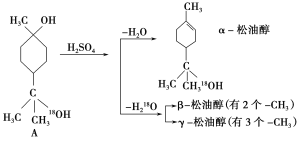
试回答:
(1)A的分子式为_____。
(2)α-松油醇能发生的反应类型是_____。
a.加成 b.水解 c.氧化
(3)写出γ-松油醇的结构简式: _________。
(4)有机物B是苧烯![]() 的同分异构体,分子结构可表示为
的同分异构体,分子结构可表示为![]() (R代表烃基),写出B可能的结构简式中的一种____。
(R代表烃基),写出B可能的结构简式中的一种____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出反应的化学方程式:
(1)由2-溴丙烷转化为丙烯________________;
(2)由1-溴丁烷和必要的无机试剂制取1,2-二溴丁烷_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的检验中,其结论一定正确的是( )
A.某溶液为蓝色,则该溶液一定是CuSO4溶液
B.向某溶液中加入Ba(NO3)2溶液无明显现象,再滴入几滴硝酸酸化的AgNO3溶液,产生白色沉淀,说明原溶液中含有Cl-
C.向某溶液中加入CaCl2溶液,产生白色沉淀,则溶液中一定含有Ag+
D.加入稀HNO3酸化的BaCl2溶液,有白色沉淀生成,证明原溶液中一定有SO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com