
【题目】一定温度下,10mL 0.40 mol·L-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 3 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是( )(溶液体积变化忽略不计)
A. 反应至6min时,H2O2分解了50%
B. 反应至6min时,c(H2O2)=0.20 mol·L-1
C. 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L·min)
D. 4~6min的平均反应速率:v(H2O2)>3.3×10-2mol/(L·min)
【答案】D
【解析】
A.0~6min时间内,生成氧气为![]() =0.001mol,由2H2O2
=0.001mol,由2H2O2![]() 2H2O+O2,可知△c(H2O2)=
2H2O+O2,可知△c(H2O2)=![]() =0.2mol/L,则H2O2分解率为
=0.2mol/L,则H2O2分解率为![]() ×100%=50%,故A正确;
×100%=50%,故A正确;
B.由A计算可知,反应至6 min时c(H2O2)=0.4mol/L-0.2mol/L=0.2mol/L,故B正确;
C.0~6min时间内,生成氧气为![]() =0.001mol,由2H2O2
=0.001mol,由2H2O2![]() 2H2O+O2,可知△c(H2O2)=
2H2O+O2,可知△c(H2O2)=![]() =0.2mol/L,所以v(H2O2)=
=0.2mol/L,所以v(H2O2)=![]() ≈0.033mol/(Lmin),故C正确;
≈0.033mol/(Lmin),故C正确;
D.由题中数据可知,0~3 min生成氧气的体积大于3~6min生成氧气的体积,因此,4~6 min的平均反应速率小于0~6min时间内反应速率,故D错误;
答案选D。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是( )

A. 该硫酸的物质的量浓度为9.2 mol·L-1
B. 1 mol Zn与足量该硫酸反应产生2 g氢气
C. 配制200 mL 4.6 mol·L-1的稀硫酸需取该硫酸50 mL
D. 该硫酸与等质量的水混合后所得溶液的浓度大于9.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型,高效、多功能绿色水处理剂,可通过KClO溶液与Fe(NO3)3溶液的反应制备。
已知:①KClO在较高温度下发生歧化反应生成KClO3
②K2FeO4具有下列性质:可溶于水、微溶于浓KOH溶液;在强碱性溶液中比较稳定;在Fe3+催化作用下发生分解,在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2,如图所示是实验室模拟工业制备KClO溶液装置。
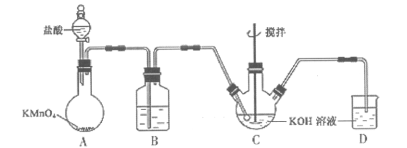
(1)B装置的作用为______________________;
(2)反应时需将C装置置于冷水浴中,其原因为__________________;
(3)制备K2FeO4时,不能将碱性的KClO溶液滴加到Fe(NO3)3饱和溶液中,其原因是________,制备K2FeO4的离子方程式_________________;
(4)工业上常用废铁屑为原料制备Fe(NO3)3溶液,溶液中可能含有Fe2+,检验Fe2+所需试剂名称________,其反应原理为______________________(用离子方程式表示);
(5)向反应后的三颈瓶中加入饱和KOH溶液,析出K2FeO4固体,过滤、洗涤、干燥。洗涤操作所用最佳试剂为______________________;
A.水 B.无水乙醇 C.稀KOH溶液
(6)工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00g K2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.0mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,装有Na2S2O3标准溶液的滴定管起始和终点读数如如图所示:
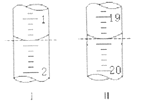
①消耗Na2S2O3标准溶液的体积为____________mL。
②原样品中高铁酸钾的质量分数为_________________。[M(K2FeO4)=198g/mol]
③若在配制Na2S2O3标准溶液的过程中定容时俯视刻度线,则导致所测高铁酸钾的质量分数____________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.
A元素原子的核外p电子数比s电子数少3 |
B元素形成的物质种类繁多.其形成的一种固体单质工业上常用作切割工具 |
C元素基态原子p轨道有3个未成对电子 |
D原子核外所有p轨道全满或半满 |
E在该周期中未成对电子数最多 |
F能形成红色(或砖红色)和黑色的两种氧化物 |
某同学根据上述信息,推断
(1)画出A基态原子的核外电子排布图____________________。
(2)B基态原子的核外电子排布图![]() , 该同学所画的电子排布图违背了____________________________________。
, 该同学所画的电子排布图违背了____________________________________。
(3)D基态原子中能量最高的电子,其电子云在空间有____________个方向,原子轨道呈____________形。
(4)写出C原子的电子排布式 ____________;写出E原子的电子简化排布式____________。
(5)请写出F元素价电子排布式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式错误的是
A.![]() 与盐酸反应:
与盐酸反应:![]()
B.![]() 溶于过量NaOH溶液: Al2O3+2OH-=2AlO2-+H2O
溶于过量NaOH溶液: Al2O3+2OH-=2AlO2-+H2O
C.铝溶于氢氧化钠溶液: 2Al+2OH-+2H2O=2AlO2-+3H2↑
D.![]() 溶于NaOH溶液:
溶于NaOH溶液:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:

请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为__________;得到滤渣1的主要成分为__________。
(2)第②步中加H2O2的作用是__________,使用H2O2的优点是__________;调溶液pH的目的是使__________生成沉淀。
(3)第③步所得CuSO4·5H2O制备无水CuSO4的方法是__________。
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
甲:滤渣2![]() 酸浸液
酸浸液![]() Al2(SO4)3·18H2O
Al2(SO4)3·18H2O
乙:滤渣2![]() 酸浸液
酸浸液![]() 滤液
滤液![]() Al2(SO4)3·18H2O
Al2(SO4)3·18H2O
丙:滤渣2![]() 滤液
滤液![]() 溶液
溶液![]() Al2(SO4)3·18H2O
Al2(SO4)3·18H2O
上述三种方案中,__________方案不可行,原因是__________;
从原子利用率角度考虑,__________方案更合理。
(5)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取ag试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用cmol·L-1EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应为:Cu2++H2Y2-=CuY2-+2H+
①写出计算CuSO4·5H2O质量分数的表达式ω=__________;
②下列操作会导致含量的测定结果偏高的是______。
a 未干燥锥形瓶
b 滴定终点时滴定管尖嘴中产生气泡
c 未除净可与EDTA反应的干扰离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去):
![]()
![]()
![]()
![]()
![]()
(1)若A是一种金属,C是淡黄色固体,则B的化学式为________________,A→C反应的化学方程式为________________。
(2)若A是一种非金属,其常见单质为黑色固体,C是最主要的温室气体,则C的分子式为_______,B→C反应的化学方程式为____________________________。A和C是否能反应?______(填“能”或“不能”),若能,写出反应的化学方程式:____________________(若不能,此空不填)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铜矿(CuFeS2)、FeCl3和乳酸[CH3CH(OH)COOH]为原料可制备有机合成催化剂CuCl和补铁剂乳酸亚铁{[CH3CH(OH)COO]2Fe}。其主要实验流程如下:

(1) FeCl3溶液与黄铜矿发生反应的离子方程式为___________________________________________。
(2)向溶液1中加入过量铁粉的目的是_______________________________________________。
(3)过滤后得到的FeCO3固体应进行洗涤,检验洗涤已完全的方法是__________________________。

(4)实验室制备乳酸亚铁的装置如图所示。
①实验前通入N2的目的是_______________________________________。
②某兴趣小组用KMnO4滴定法测定样品中Fe2+含量进而计算产品中乳酸亚铁的质量分数,结果测得产品的质量分数总是大于100%,其原因可能是_______________________________________________。
(5)已知:
①CuCl为白色晶体,难溶于水和乙醇,在空气中易氧化;可与NaCl溶液反应,生成易溶于水的NaCuCl2。
②NaCuCl2可水解生成CuCl,温度、pH对CuCl产率的影响如图所示。


由CuCl(s)、S(s)混合物提纯CuCl的实验方案为:将一定量的混合物溶于饱和NaCl溶液中,________________________________________________________________________。(实验中须使用的试剂有:饱和NaCl溶液,0.1 mol·L-1 H2SO4、乙醇;除常用仪器外须使用的仪器有:真空干燥箱)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁衍生物H的合成路线如图所示:

已知:i. RCH2Br![]() RHC-CH-R
RHC-CH-R
ii. ![]()
(1)A属于芳香烃,其名称是__________。
(2)B的结构简式是__________;写出符合下列条件的B的一种同分异构体:①苯环上只有一个取代基,②能发生银镜反应,③能发生水解反应,该物质的结构简式为__________。
(3)由C生成D的化学方程式是__________。
(4)由G生成H的反应类型是__________,1molF与足量NaOH溶液反应,消耗__________molNaOH。
(5)试剂b是__________。
(6)下列说法正确的是______(选填字母序号)
a.G存在顺反异构体
b.1molG最多可以与1molH2发生加成反应
c.1molH与足量NaOH溶液反应,消耗2molNaOH
(7)以乙烯为起始原料,结合已知信息选用必要的无机试剂合成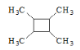 ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)__________。
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com