
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:

请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为__________;得到滤渣1的主要成分为__________。
(2)第②步中加H2O2的作用是__________,使用H2O2的优点是__________;调溶液pH的目的是使__________生成沉淀。
(3)第③步所得CuSO4·5H2O制备无水CuSO4的方法是__________。
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
甲:滤渣2![]() 酸浸液
酸浸液![]() Al2(SO4)3·18H2O
Al2(SO4)3·18H2O
乙:滤渣2![]() 酸浸液
酸浸液![]() 滤液
滤液![]() Al2(SO4)3·18H2O
Al2(SO4)3·18H2O
丙:滤渣2![]() 滤液
滤液![]() 溶液
溶液![]() Al2(SO4)3·18H2O
Al2(SO4)3·18H2O
上述三种方案中,__________方案不可行,原因是__________;
从原子利用率角度考虑,__________方案更合理。
(5)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取ag试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用cmol·L-1EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应为:Cu2++H2Y2-=CuY2-+2H+
①写出计算CuSO4·5H2O质量分数的表达式ω=__________;
②下列操作会导致含量的测定结果偏高的是______。
a 未干燥锥形瓶
b 滴定终点时滴定管尖嘴中产生气泡
c 未除净可与EDTA反应的干扰离子
【答案】Cu+4H++2NO3-![]() Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-
Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-![]() 3Cu2++2NO↑+4H2O Pt、Au 将Fe2+氧化为Fe3+ 不引入杂质,对环境无污染 Al3+、Fe3+ 加热脱水 甲 所得产品中含有较多Fe2(SO4)3杂质 乙
3Cu2++2NO↑+4H2O Pt、Au 将Fe2+氧化为Fe3+ 不引入杂质,对环境无污染 Al3+、Fe3+ 加热脱水 甲 所得产品中含有较多Fe2(SO4)3杂质 乙 ![]() ×100% c
×100% c
【解析】
稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+,滤渣1 的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+,滤液1中加入过氧化氢,将Fe2+氧化为Fe3+,再加入氢氧化钠并调节溶液pH使Al3+、Fe3+生成沉淀,滤液2中主要含有Cu2+,然后将硫酸铜溶液蒸发、冷却结晶、过滤得到硫酸铜晶体;将滤渣2(主要含有氢氧化铁和氢氧化铝)经过一系列步骤制取Al2(SO4)3·18H2O。结合物质的性质分析解答。
(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+;所以滤渣1的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+;第①步Cu与酸反应的离子方程式为:Cu+4H++2NO3-![]() Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-
Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-![]() 3Cu2++2NO↑+4H2O,故答案为:Cu+4H++2NO3-
3Cu2++2NO↑+4H2O,故答案为:Cu+4H++2NO3- ![]() Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-
Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-![]() 3Cu2++2NO↑+4H2O;Pt、Au,
3Cu2++2NO↑+4H2O;Pt、Au,
(2)第②步加H2O2的作用是把Fe2+氧化为Fe3+,过氧化氢做氧化剂不引入杂质,对环境无污染,根据流程图,调溶液pH的目的是使Al3+、Fe3+生成沉淀,故答案为:将Fe2+氧化为Fe3+;不引入杂质,对环境无污染;Al3+、Fe3+;
(3)第③步由CuSO4·5H2O制备无水CuSO4的方法是在坩埚中加热脱水,故答案为:在坩埚中加热脱水;
(4)制备硫酸铝晶体的甲、乙、丙三种方法中,甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,方法不可行;乙和丙方法均可行;乙方案先在滤渣中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加Al粉和Fe2(SO4)3生成Al2(SO4)3,过滤除去生成的铁和过量的铝粉,将滤液蒸发、冷却、结晶、过滤可得硫酸铝晶体;丙方案先在滤渣中加NaOH和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;但从原子利用角度考虑方案乙更合理,因为丙加的NaOH和制备的Al2(SO4)3的原子组成没有关系,造成药品浪费,故答案为:甲;所得产品中含有较多Fe2(SO4)3杂质;乙;
(5)①取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用c molL-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液6mL,滴定反应如下:Cu2++H2Y2-=CuY2-+2H+,铜离子物质的量和标准液物质的量相同cmol/L×b×10-3L=bc×10-3mol;依据元素守恒得到:则20mL溶液中含有的CuSO45H2O物质的量为bc×10-3mol;100mL溶液中含bc×10-3mol×5=5bc×10-3mol,所以CuSO45H2O质量分数的表达式=![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%;
×100%;
②a.未干燥锥形瓶对实验结果无影响,故错误;b.滴定终点时滴定管尖嘴中产生气泡,导致消耗标准液读数偏小,结果偏低,故错误;c.未除净可与EDTA反应的干扰离子,导致消耗标准液多,结果偏高,故正确;导致含量的测定结果偏高的是c,故答案为:c。


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是

A. 金属性:甲>乙>丁
B. 乙的单质在空气中燃烧生成只含离子键的化合物
C. 原子半径:辛>己>戊
D. 丙与庚的原子核外电子数相差3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是课外活动小组设计的用化学电源使LED灯发光的装置。下列说法正确的是
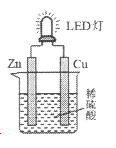
A. 溶液中的SO42-向铜极移动
B. 锌片为原电池的负极,发生还原反应
C. 如果将稀硫酸换成柠檬汁,导线中不会有电子流动
D. 铜片表面有气泡生成,发生的反应为:2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应对应的离子方程式,书写正确的是
A.氢氧化钡溶液与稀盐酸的反应:![]()
B.澄清石灰水与稀盐酸的反应:![]()
C.铜片插入硝酸汞溶液中:![]()
D.碳酸钙溶于稀盐酸中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10mL 0.40 mol·L-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 3 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是( )(溶液体积变化忽略不计)
A. 反应至6min时,H2O2分解了50%
B. 反应至6min时,c(H2O2)=0.20 mol·L-1
C. 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L·min)
D. 4~6min的平均反应速率:v(H2O2)>3.3×10-2mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型NaBH4/H2O2燃料电池DBFC的结构如图所示,该电池总反应方程式:NaBH4 +4H2O2= NaBO2+ 6H2O,有关的说法不正确的是

A. 电极B为正极
B. 放电过程中,Na+从正极区向负极区迁移
C. 电池负极的电极反应为:BH4-+8OH8e=BO2-+6H2O
D. 在电池反应中,每消耗1L6mol/LH2O2溶液,理论上流过电路中的电子为12NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如图所示的实验装置进行铁跟水蒸气反应的实验,并研究铁及其化合物的部分性质。请回答下列问题:
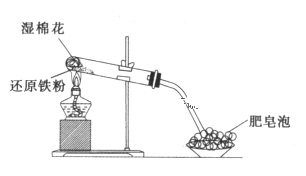
(1)硬质试管中发生反应的化学方程式为_______________________________。
(2)该同学为确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色,则说明硬质试管的固体物质中一定有_________,可能有__________________;若溶液未变红色,则说明硬质试管中固体物质的成分是_____________________________________。
(3)该同学按(2)中所述实验方案进行了实验,结果溶液未变红色,原因是________________________________(用离子方程式表示)。
(4)该同学马上另取少量溶液B,使其与NaOH溶液反应。若按图所示操作,可观察到试管中先生成白色沉淀,后沉淀迅速变成灰绿色,最后变成红褐色的现象,请写出白色沉淀变为红褐色的过程中所发生反应的化学方程式:__________________________________。
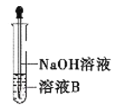
(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明![]() 具有_________性。由此可知,实验室中含
具有_________性。由此可知,实验室中含![]() 的盐溶液需现用现配制的原因是__________,并且配制含
的盐溶液需现用现配制的原因是__________,并且配制含![]() 的盐溶液时应加入少量___________________。
的盐溶液时应加入少量___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种应用广泛的金属,在工业上用![]() 和冰晶石
和冰晶石![]() 混合熔电解制得。
混合熔电解制得。
Ⅰ.铝土矿的主要成分是![]() 和
和![]() 等。从铝土矿中提炼
等。从铝土矿中提炼![]() 的流程如下:
的流程如下:

(1)写出反应1中涉及的任意一个化学方程式______;
(2)滤液Ⅰ中加入的CaO生成的沉淀是_____,已知气体A在标准状况下的密度为1.96g/L,反应2的离子方程式为______;
Ⅱ.以萤石![]() 和纯碱为原料制备冰晶石的流程如下:
和纯碱为原料制备冰晶石的流程如下:

(3)萤石![]() 的电子式______;
的电子式______;
(4)若E为硫酸钙,D为最稳定的气态氢化物,则化合物C是______,写出由D制备冰晶石![]() 的化学方程式_______;
的化学方程式_______;
(5)工业电解制铝若以石墨为电极,阳极产生的混合气体的成分是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z 是中学化学常见的三种物质,它们之间的相互转化关系如下(X、Y、Z、E、F 为英文字母,部分反应条件及产物略去)

I.若Y是一种易溶于水,且能使品红溶液褪色的无色刺激性气味的气体。
(1)Y气体的大量排放会形成酸雨,在工业上可以用足量氨水吸收,化学方程式为_____。
(2)Z的水溶液可以制得某种强酸 E。实验室用 98%的浓 E(ρ = 1.84g·cm3)溶液配制l.5mol·L1稀 E 溶液240mL。
① 制该稀 E 溶液需要使用的玻璃仪器有胶头滴管、量筒、烧杯、玻璃棒 和_____ ;
II.若Z是淡黄色固体粉末。
在呼吸面具或潜水艇中由Z和 CO2制备氧气的化学反应方程式为_____。
III.若Z是红棕色气体。
(1)试写出 Z 与水反应制备另一种强酸 F 的化学方程式_____。
(2)2.0g铜镁合金完全溶解于100mL 密度为 1.40g·mL1质量分数为 63%的浓F溶液中,得到Z 和N2O4(Z和N2O4均为浓F 溶液的还原产物)的混合气体1792mL(标准状况),向反应后的溶液中加入1.0mol·L1NaOH 溶液,当金属离子全部沉淀,得到3.7g沉淀。则合金中铜与镁的物质的量之比为_____,加入 NaOH 溶液的体积为_____ mL 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com