
【题目】X、Y、Z 是中学化学常见的三种物质,它们之间的相互转化关系如下(X、Y、Z、E、F 为英文字母,部分反应条件及产物略去)

I.若Y是一种易溶于水,且能使品红溶液褪色的无色刺激性气味的气体。
(1)Y气体的大量排放会形成酸雨,在工业上可以用足量氨水吸收,化学方程式为_____。
(2)Z的水溶液可以制得某种强酸 E。实验室用 98%的浓 E(ρ = 1.84g·cm3)溶液配制l.5mol·L1稀 E 溶液240mL。
① 制该稀 E 溶液需要使用的玻璃仪器有胶头滴管、量筒、烧杯、玻璃棒 和_____ ;
II.若Z是淡黄色固体粉末。
在呼吸面具或潜水艇中由Z和 CO2制备氧气的化学反应方程式为_____。
III.若Z是红棕色气体。
(1)试写出 Z 与水反应制备另一种强酸 F 的化学方程式_____。
(2)2.0g铜镁合金完全溶解于100mL 密度为 1.40g·mL1质量分数为 63%的浓F溶液中,得到Z 和N2O4(Z和N2O4均为浓F 溶液的还原产物)的混合气体1792mL(标准状况),向反应后的溶液中加入1.0mol·L1NaOH 溶液,当金属离子全部沉淀,得到3.7g沉淀。则合金中铜与镁的物质的量之比为_____,加入 NaOH 溶液的体积为_____ mL 。
【答案】2NH3H2O+SO2=(NH4)2SO3+H2O 250mL容量瓶 2Na2O2+2CO2=2Na2CO3+O2 3NO2+H2O=2HNO3+NO 2:3 1300
【解析】
I.若Y是一种易溶于水,且能使品红溶液褪色的无色刺激性气味的气体,则Y为SO2;
II.若Z是淡黄色固体粉末,则Z为Na2O2;
III.若Z是红棕色气体,则Z为NO2,X为N2或NH3,Y为NO。
I.(1)根据分析,Y为SO2,SO2的大量排放会形成酸雨,在工业上可以用足量氨水吸收,生成亚硫酸铵和水,其反应的化学方程式为:2NH3H2O+SO2=(NH4)2SO3+H2O,故答案为:2NH3H2O+SO2=(NH4)2SO3+H2O。
(2)①二氧化硫氧化生成三氧化硫,三氧化硫溶于水得硫酸,E是硫酸。实验室用98%浓硫酸(ρ=1.84mgcm3)溶液配制1.5molL1稀硫酸溶液240mL,依据配制溶液的步骤可知,需用的玻璃仪器有胶头滴管、量筒、烧杯、玻璃棒、250mL容量瓶,故答案为:250mL容量瓶。
II. 根据分析,Z为Na2O2,在呼吸面具或潜水艇中Na2O2和CO2制备O2的化学反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2。
III.(1) Z为NO2,X为N2或NH3,Y为NO,NO2与H2O反应生成HNO3和NO,其化学反应方程式为:3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO。
(2)F为HNO3,金属离子全部沉淀时,得到3.7g沉淀为氢氧化铜和氢氧化镁,所以沉淀中氢氧根离子的质量为3.7g2g=1.7g,氢氧根离子的物质的量为: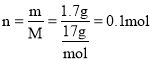 ,根据电荷守恒可知,金属提供的电子的物质的量等于氢氧根离子的物质的量,设铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:
,根据电荷守恒可知,金属提供的电子的物质的量等于氢氧根离子的物质的量,设铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:![]() ,计算得出:
,计算得出:![]() ,所以合金中铜与镁的物质的量之比是0.02:0.03=2:3;标准状况下,NO2和N2O4混合气体的物质的量为:
,所以合金中铜与镁的物质的量之比是0.02:0.03=2:3;标准状况下,NO2和N2O4混合气体的物质的量为:![]() ,设二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.08a)mol,根据电子转移守恒可知,a×1+(0.08a)×2×1=0.1,计算得出:a=0.06mol,则N2O4的物质的量为0.02mol,根据钠离子守恒可知,氢氧化钠的物质的量等于反应后溶液中硝酸钠的物质的量,根据氮元素守恒可知,硝酸钠的物质的量为:
,设二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.08a)mol,根据电子转移守恒可知,a×1+(0.08a)×2×1=0.1,计算得出:a=0.06mol,则N2O4的物质的量为0.02mol,根据钠离子守恒可知,氢氧化钠的物质的量等于反应后溶液中硝酸钠的物质的量,根据氮元素守恒可知,硝酸钠的物质的量为:![]() 0.06mol0.02mol×2=1.3mol,所以需要氢氧化钠溶液的体积为:
0.06mol0.02mol×2=1.3mol,所以需要氢氧化钠溶液的体积为: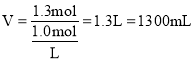 ,故答案为:2:3;1300。
,故答案为:2:3;1300。


科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:

请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为__________;得到滤渣1的主要成分为__________。
(2)第②步中加H2O2的作用是__________,使用H2O2的优点是__________;调溶液pH的目的是使__________生成沉淀。
(3)第③步所得CuSO4·5H2O制备无水CuSO4的方法是__________。
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
甲:滤渣2![]() 酸浸液
酸浸液![]() Al2(SO4)3·18H2O
Al2(SO4)3·18H2O
乙:滤渣2![]() 酸浸液
酸浸液![]() 滤液
滤液![]() Al2(SO4)3·18H2O
Al2(SO4)3·18H2O
丙:滤渣2![]() 滤液
滤液![]() 溶液
溶液![]() Al2(SO4)3·18H2O
Al2(SO4)3·18H2O
上述三种方案中,__________方案不可行,原因是__________;
从原子利用率角度考虑,__________方案更合理。
(5)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取ag试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用cmol·L-1EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应为:Cu2++H2Y2-=CuY2-+2H+
①写出计算CuSO4·5H2O质量分数的表达式ω=__________;
②下列操作会导致含量的测定结果偏高的是______。
a 未干燥锥形瓶
b 滴定终点时滴定管尖嘴中产生气泡
c 未除净可与EDTA反应的干扰离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的化学用语表达正确的是( )
A | 质子交换膜氢氧燃料电池的负极反应 | O2+2H2O+4e﹣=4OH﹣ |
B | 用铁电极电解饱和食盐水 | 2Cl﹣+2H2O=Cl2↑+H2↑+20H﹣ |
C | 锅炉水垢中的CaSO4用饱和Na3CO3溶液浸泡 | CO32﹣+CaSO4=CaCO3+SO42﹣ |
D | KClO碱性溶液与Fe(OH)3反应制取K2FeO4 | 3ClO﹣+2Fe(OH)3=2FeO43﹣+3Cl﹣+4H++H2O |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述中,正确的是( )
|
|
|
|
图Ⅰ 碱性锌锰电池 | 图Ⅱ铅硫酸蓄电池 | 图Ⅲ 电解精炼铜 | 图Ⅳ 银锌纽扣电池 |
A. 图Ⅰ所示电池中,MnO2的作用是催化剂
B. 图Ⅱ所示电池放电过程中,正极质量不断增大
C. 图Ⅲ所示装置工作过程中,电解质溶液浓度始终不变
D. 图Ⅳ所示电池中,放电时,负极附近溶液的pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁衍生物H的合成路线如图所示:

已知:i. RCH2Br![]() RHC-CH-R
RHC-CH-R
ii. ![]()
(1)A属于芳香烃,其名称是__________。
(2)B的结构简式是__________;写出符合下列条件的B的一种同分异构体:①苯环上只有一个取代基,②能发生银镜反应,③能发生水解反应,该物质的结构简式为__________。
(3)由C生成D的化学方程式是__________。
(4)由G生成H的反应类型是__________,1molF与足量NaOH溶液反应,消耗__________molNaOH。
(5)试剂b是__________。
(6)下列说法正确的是______(选填字母序号)
a.G存在顺反异构体
b.1molG最多可以与1molH2发生加成反应
c.1molH与足量NaOH溶液反应,消耗2molNaOH
(7)以乙烯为起始原料,结合已知信息选用必要的无机试剂合成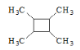 ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)__________。
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于强弱电解质,下列说法正确的是
A. 液态HC1和液态H2O中都不存在离子
B. 室温下,硫酸溶液的pH—定小于醋酸溶液
C. 二种弱电解质在一定条件下可以相互反应生成强电解质
D. NaX在水中的电离方程式为NaX=Na++X-,因此HX是一种强电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,下列有关离子浓度关系的比较,正确的是

A. A、B之间任意一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C. C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D. D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计如图装置:

(1)a和b不连接时,烧杯中现象是 。
(2)a和b用导线连接,Cu极为原电池_________极(填“正”或“负”),
电极反应式为: ;溶液中H+移向____________
(填“Cu”或“Zn”)极。电池总反应式为: 。
若电解质溶液改为AgNO3溶液,当转移0.2mol电子时,则理论上Cu片质量变化为___ ___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为周期表的一部分,表中所列的字母分别代表一种化学元素。回答下列问题:

(1)f的基态原子核外电子排布式______。
(2)在c2a4分子中,c为______杂化,c与c间存在的共价键类型有______两种。
(3)ci2与ce2比较,沸点较高的是______(写分子式),其原因是_________________。
(4)将氨水滴入到j的硫酸盐溶液中,先产生蓝色沉淀,然后沉淀逐渐溶解并得到深蓝色溶液。深蓝色溶液是由于存在______(写结构式),其中配体是_____。
(5)j的金属晶体的晶胞如图所示,则一个晶胞中每个j原子周围与它最接近且距离相等的j共有的个数是______个,已知该元素的相对原子质量为64,单质晶体的密度为ρg·cm-3,阿伏加德罗常数的值为NA,试求铜的金属半径为__________ pm(用含NA、ρ的表达式表达)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com