
【题目】下列化学反应对应的离子方程式,书写正确的是
A.氢氧化钡溶液与稀盐酸的反应:![]()
B.澄清石灰水与稀盐酸的反应:![]()
C.铜片插入硝酸汞溶液中:![]()
D.碳酸钙溶于稀盐酸中:![]()
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 过量SO2通入到Ba(NO3)2溶液中:3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO+4H+
B. Fe(OH)2溶于稀HNO3:Fe(OH)2+2H+=Fe2++2H2O
C. H![]() O2中加入H2SO4酸化的KMnO4:5H
O2中加入H2SO4酸化的KMnO4:5H![]() O2+2MnO4-+6H+=518O2↑+2Mn2++8H2O
O2+2MnO4-+6H+=518O2↑+2Mn2++8H2O
D. 用铜电极电解硫酸铜溶液:2Cu2++2H2O![]() 2Cu↓+O2↑+4H+
2Cu↓+O2↑+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将图1所示的装置中盐桥换成铜导线与两石墨棒连接得到图2所示装置,并将NaCl溶液换为HCl溶液,发现电流表指针仍然有偏转,下列说法正确的是( )

A. 图1盐桥中的阳离子移向甲装置
B. 两图都是将化学能转变成电能的装置
C. 图2中乙装置总反应的离子方程式:Cu2++2Cl-![]() Cu+Cl2↑
Cu+Cl2↑
D. 图2中电子流向为Fe→电流计![]() 石墨→石墨b→石墨c→Fe
石墨→石墨b→石墨c→Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
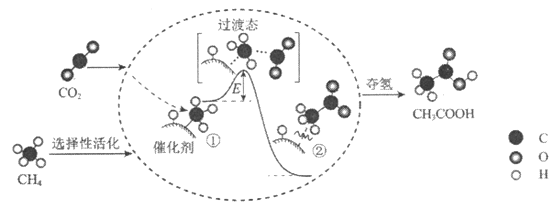
下列说法不正确的是
A. 该反应是化合反应
B. 催化剂参加了化学反应过程
C. CH4→CH3COOH过程中,有C—H键的断裂和形成
D. ①→②过程中,形成了C—C键,断裂的化学键的总键能<形成的化学键的总键能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.
A元素原子的核外p电子数比s电子数少3 |
B元素形成的物质种类繁多.其形成的一种固体单质工业上常用作切割工具 |
C元素基态原子p轨道有3个未成对电子 |
D原子核外所有p轨道全满或半满 |
E在该周期中未成对电子数最多 |
F能形成红色(或砖红色)和黑色的两种氧化物 |
某同学根据上述信息,推断
(1)画出A基态原子的核外电子排布图____________________。
(2)B基态原子的核外电子排布图![]() , 该同学所画的电子排布图违背了____________________________________。
, 该同学所画的电子排布图违背了____________________________________。
(3)D基态原子中能量最高的电子,其电子云在空间有____________个方向,原子轨道呈____________形。
(4)写出C原子的电子排布式 ____________;写出E原子的电子简化排布式____________。
(5)请写出F元素价电子排布式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】长托宁是一种选择性抗胆碱药,通过以下方法可合成。

已知:试剂![]() 的结构简式为
的结构简式为
回答下列问题
(1)长托宁![]() 的分子式为:_________________,其中含氧官能团的名称为_______________。
的分子式为:_________________,其中含氧官能团的名称为_______________。
(2)反应④的反应类型为__________________,反应⑤的反应类型为_________________。
(3)一定条件下![]() 可以聚合成高分子化合物,请写出该过程的化学方程式________________。
可以聚合成高分子化合物,请写出该过程的化学方程式________________。
(4)下列有关图中物质的说法中,正确的有_______(选填字母)。
a. 利用核磁共振氢谱可以区分![]() 和
和![]() b.
b. ![]() 分子中所有原子可能处于同一平面
分子中所有原子可能处于同一平面
c. ![]() 与氯气进行1:1的加成反应,可以得到两种产物
与氯气进行1:1的加成反应,可以得到两种产物
d. ![]() 最多可以与
最多可以与![]() 氢气发生加成反应
氢气发生加成反应
(5)通过常温下的反应,区别![]() 和
和![]() 的试剂是_____________和____________。
的试剂是_____________和____________。
(6)![]() 的某此芳香类同分异构体可以水解,且
的某此芳香类同分异构体可以水解,且![]() 该物质水解最多消耗
该物质水解最多消耗![]() ,这样的同分异构体共有_______种。
,这样的同分异构体共有_______种。
(7)根据已有的知识并结合相关信息,写出以![]() 和
和 为原料制备
为原料制备 的合成流程图(无机试剂任选)_________________。
的合成流程图(无机试剂任选)_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:

请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为__________;得到滤渣1的主要成分为__________。
(2)第②步中加H2O2的作用是__________,使用H2O2的优点是__________;调溶液pH的目的是使__________生成沉淀。
(3)第③步所得CuSO4·5H2O制备无水CuSO4的方法是__________。
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
甲:滤渣2![]() 酸浸液
酸浸液![]() Al2(SO4)3·18H2O
Al2(SO4)3·18H2O
乙:滤渣2![]() 酸浸液
酸浸液![]() 滤液
滤液![]() Al2(SO4)3·18H2O
Al2(SO4)3·18H2O
丙:滤渣2![]() 滤液
滤液![]() 溶液
溶液![]() Al2(SO4)3·18H2O
Al2(SO4)3·18H2O
上述三种方案中,__________方案不可行,原因是__________;
从原子利用率角度考虑,__________方案更合理。
(5)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取ag试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用cmol·L-1EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应为:Cu2++H2Y2-=CuY2-+2H+
①写出计算CuSO4·5H2O质量分数的表达式ω=__________;
②下列操作会导致含量的测定结果偏高的是______。
a 未干燥锥形瓶
b 滴定终点时滴定管尖嘴中产生气泡
c 未除净可与EDTA反应的干扰离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联合国宣布2019年为“国际化学元素周期表年”。现有四种不同主族短周期元素X、Y、Z、W的原子序数依次递增,X与Y形成的化合物是光合作用的原料之一,Z、W处于同周期且族序数相差6。下列说法正确的是
A. 元素非金属性:![]()
B. Y和Z形成的化合物中只存在离子键
C. Z、W的简单离子半径:![]()
D. 只有W元素的单质可用于杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述中,正确的是( )
|
|
|
|
图Ⅰ 碱性锌锰电池 | 图Ⅱ铅硫酸蓄电池 | 图Ⅲ 电解精炼铜 | 图Ⅳ 银锌纽扣电池 |
A. 图Ⅰ所示电池中,MnO2的作用是催化剂
B. 图Ⅱ所示电池放电过程中,正极质量不断增大
C. 图Ⅲ所示装置工作过程中,电解质溶液浓度始终不变
D. 图Ⅳ所示电池中,放电时,负极附近溶液的pH不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com