
【题目】下列反应的现象描述与离子方程式都正确的是( )
A.金属镁与稀盐酸反应:有气泡逸出Mg+2H++2Cl-=MgCl2+H2↑
B.氯化钡溶液与稀硫酸反应:有白色沉淀生成 Ba2++SO42—=BaSO4↓
C.碳酸钠溶液与盐酸反应:有气泡逸出 Na2CO3+2H+=2Na++CO2↑+H2O
D.NaHCO3溶液中加入过量的Ba(OH)2溶液:有白色沉淀产生2HCO![]() +Ba2++2OH-===BaCO3↓+2H2O+CO32—
+Ba2++2OH-===BaCO3↓+2H2O+CO32—
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,10mL 0.40 mol·L-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 3 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是( )(溶液体积变化忽略不计)
A. 反应至6min时,H2O2分解了50%
B. 反应至6min时,c(H2O2)=0.20 mol·L-1
C. 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L·min)
D. 4~6min的平均反应速率:v(H2O2)>3.3×10-2mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。
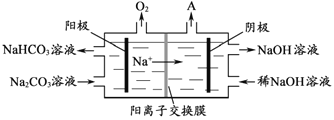
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
(1) N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)→2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是__________。
A.N2O分解反应中:分解速率与是否含碘蒸气有关 B.第三步对总反应速率起决定作用
C.第二步活化能比第三步小 D.IO为反应的催化剂
(2)汽车尾气中含有较多的氮氧化物和不完全燃烧的CO,汽车三元催化器可以实现降低氮氧化物的排放量。汽车尾气中的NO(g)和CO(g)在催化剂的作用下转化成两种无污染的气体。如,
反应I:2CO +2NO → N2+2CO2 △H1; 反应II:4CO +2NO2 → N2+4CO2 △H2<0。
针对反应I:①已知:反应N2(g)+O2(g)=2NO(g) △H3=+180.0kJ·mol1,若CO的燃烧热为-283.5kJ·moll 则反应I的△H1=_________kJ·mol1。
②若在恒容的密闭容器中,充入2molCO和1molNO,发生反应I,下列选项中不能说明该反应已经达到平衡状态的是_______。
A.CO和NO的物质的量之比不变 B.混合气体的密度保持不变
C.混合气体的压强保持不变 D.2v(N2)正=v(CO)逆
(3)根据原电池原理和电解原理进行如图回答。请回答: 用如图所示装置进行实验(K闭合).
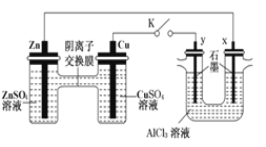
①Zn极为________极;实验过程中,SO42-________(填“从左向右”、“从右向左”或“不”)移动。
②y极的电极反应现象为________;
③写出生活中对钢闸门的一种电化学保护方法________________________。
④有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HClNH4Cl为电解质溶液制取新型燃料电池,请写出该电池的正极反应式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的检验中,其结论一定正确的是( )
A.某溶液为蓝色,则该溶液一定是CuSO4溶液
B.向某溶液中加入Ba(NO3)2溶液无明显现象,再滴入几滴硝酸酸化的AgNO3溶液,产生白色沉淀,说明原溶液中含有Cl-
C.向某溶液中加入CaCl2溶液,产生白色沉淀,则溶液中一定含有Ag+
D.加入稀HNO3酸化的BaCl2溶液,有白色沉淀生成,证明原溶液中一定有SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为:KClO3+HCl(浓)== KCl+ClO2↑+Cl2↑+。
(1)请 写出完整的化学方程式并配平_______。
(2)浓盐酸在反应中显示出来的性质是_______(填写编号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)用双线桥法标明电子转移的方向和数目____。
(4)产生0.1molCl2,则转移的电子的物质的量为___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍钴锰酸锂电池是一种高功率动力电池。采用废旧锂离子电池回收工艺制备镍钴锰酸锂三元正极材料(铝电极表面涂有LiNi1-x-yCoxMnyO2)的工艺流程如图所示:
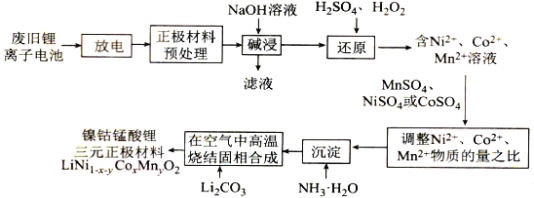
回答下列问题
(1)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极的回收,其原因是_______。
(2)能够提高“碱浸”效率的方法有______(至少写两种)。
(3)“碱浸”过程中,铝溶解的离子方程式为_____。
(4)实验室模拟“碱浸”后过滤的操作,过滤后需洗涤,简述洗涤的操作过程:_____。
(5)LiCoO2参与“还原”反应的离子方程式为_______。
(6)溶液温度和浸渍时间对钴的浸出率影响如图所示,则浸出过程的最佳条件是______。
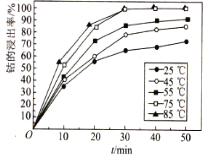
(7)已知溶液中Co2+的浓度为1.0mol·L-1,缓慢通入氨气,使其产生Co(OH)2沉淀,则Co2+沉淀完全时溶液的最小pH为______(已知:离子沉淀完全时c(Co2+)≤1.0×10-5mol·L-1,Ksp[Co(OH)2]=4.0×10-15,1g5=0.7,1g2=0.3,溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸的体积有如图所示的关系(不考虑CO2在水中的溶解)。下列说法不正确的是( )
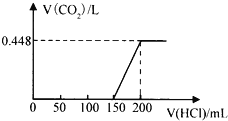
A. 滴加盐酸0→150mL段发生的反应依次为OH-+H+=H2O、CO32-+H+=HCO3-
B. 所用盐酸的物质的量浓度为0.4 molL﹣1
C. CO2体积不再改变时,溶液中的溶质为NaCl
D. 该样品中NaOH与Na2CO3物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为两套实验装置。
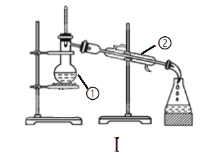
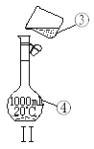
(1)写出下列仪器的名称:
①____;②___ 。
(2)仪器①~④中,使用时必须检查是否漏水的有____。(填序号)
(3)若利用装置I制取蒸馏水,还缺少的仪器是____。
(4)实验室欲使用480mL0.2mol·L-1 CuSO4溶液,配制该溶液包含以下步骤:
A.称取一定质量胆矾(CuSO4·5H2O)放入烧杯,用适量蒸馏水将其完全溶解;
B.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液都转入容量瓶中,并轻轻摇匀;
C.继续向容量瓶中加蒸馏水至凹液面距刻度线1~2cm时,改用胶头滴管滴加,直到溶液的凹液面恰好与刻度线相切为止;
D.把溶液小心地注入容量瓶中;
E.将容量瓶塞好充分摇匀。
请填写下列空白:
①用托盘天平称量胆矾,应该称取的质量是___。
②上述操作的正确顺序是___。
③实验用到的仪器有托盘天平(砝码)、药匙、烧杯、玻璃棒、胶头滴管、___等,玻璃棒的作用是___。
④下列情况中会导致所配溶液浓度偏小的是___(填序号)。
a.容量瓶使用前未干燥
b.转移溶液后,烧杯没有洗涤
c.定容过程观察容量瓶内液面时,俯视刻度线
d.颠倒摇匀后,发现液面低于刻度线,不作任何处置
e.加蒸馏水时不慎超过刻度线,用滴管小心地吸去超出部分,使液面与刻度线相切
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com