
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为:KClO3+HCl(浓)== KCl+ClO2↑+Cl2↑+。
(1)请 写出完整的化学方程式并配平_______。
(2)浓盐酸在反应中显示出来的性质是_______(填写编号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)用双线桥法标明电子转移的方向和数目____。
(4)产生0.1molCl2,则转移的电子的物质的量为___mol。
【答案】2KClO3+4HCl(浓)== 2KCl+2ClO2↑+Cl2↑+2H2O ② 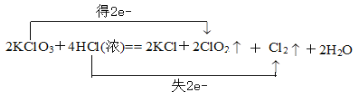 0.1
0.1
【解析】
(1)根据元素守恒可知产物中有水生成;根据得失电子守恒配平方程式;
(2) HCl中的部分氯元素化合价由-1升高为0、HCl中部分氯元素化合价不变生成KCl;
(3)KClO3中氯元素化合价由+5降低为+4,HCl中氯元素化合价由-1升高为0;
(4)根据(3)计算产生0.1molCl2转移的电子的物质的量。
(1)根据元素守恒可知产物中有水生成,KClO3中氯元素化合价由+5降低为+4,HCl中氯元素化合价由-1升高为0,根据得失电子守恒,配平方程式为2KClO3+4HCl(浓)== 2KCl+2ClO2↑+Cl2↑+2H2O;
(2) HCl中的部分氯元素化合价由-1升高为0,所以HCl表现还原性,HCl中部分氯元素化合价不变生成KCl,所以HCl表现酸性,故选②;
(3)KClO3中氯元素化合价由+5降低为+4,HCl中氯元素化合价由-1升高为0,电子转移的方向和数目是 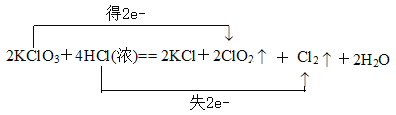 ;
;
(4)根据(3)可知,生成2mol Cl2转移2mol电子,所以产生0.1molCl2转移的电子的物质的量为0.1mol。


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】(1)同分异构现象在有机化合物中是非常普遍的。下列各组化合物:
①CH3CH2CH2CH3和(CH3)2CHCH3;②CH3CH2OH和CH3CH2CH2OH;③CH3CH=CHCH3和CH3CH2CH=CH2;④![]() 和
和![]() ,其中互为同分异构体的是_______(填序号)。
,其中互为同分异构体的是_______(填序号)。
(2)下列属于酚的是________。
①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤![]() ⑥
⑥![]()
(3)如图所示是几种烷烃的球棍模型,试回答下列问题:
A、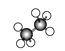 B、
B、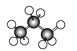 C、
C、![]()
①A、B、C三者的关系是____。
②A的分子式为____,C的名称为_____。
③写出C的同分异构体的结构简式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
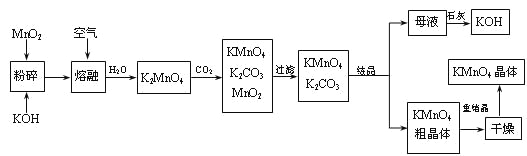
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列___(填序号)物质相似。
A.75%酒精 B.双氧水 C.苯酚 D.84消毒液(NaClO溶液)
(2)写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:
___________________________________________________________________。
(3)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是:_______。
(4)上述流程中可以循环使用的物质有石灰、二氧化碳、___和___(写化学式)。
(5)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得_____mol KMnO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)胃舒平是治疗胃酸(HCl)过多的常用药物,其中含有的有效成分是不溶物氢氧化铝。其治疗原理是(用离子方程式表示)_______。
(2)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,生成两种化合物,其中一种是还原性气体且有毒性,该反应的化学方程式是_______。
(3)反应2H2CrO4+3H2O2=2Cr(OH)3 +3O2↑+2H2O中H2O2的变化过程为H2O2→O2。
①该反应的还原剂是________(填化学式)。
②在该反应方程式中用双线桥法标明电子转移的方向和数目。________
2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O
③若反应中转移了3mol电子,则产生的气体在标准状况下体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的现象描述与离子方程式都正确的是( )
A.金属镁与稀盐酸反应:有气泡逸出Mg+2H++2Cl-=MgCl2+H2↑
B.氯化钡溶液与稀硫酸反应:有白色沉淀生成 Ba2++SO42—=BaSO4↓
C.碳酸钠溶液与盐酸反应:有气泡逸出 Na2CO3+2H+=2Na++CO2↑+H2O
D.NaHCO3溶液中加入过量的Ba(OH)2溶液:有白色沉淀产生2HCO![]() +Ba2++2OH-===BaCO3↓+2H2O+CO32—
+Ba2++2OH-===BaCO3↓+2H2O+CO32—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“化学计量在实验中的应用”的相关知识进行填空(设NA表示阿伏加德罗常数的值)。
(1)标准状况下,0.2 mol氨气的体积是__________, 其中含有的NH3分子数是__________,
(2) 20℃时,饱和KCl溶液的密度为0.745g·cm﹣3,物质的量浓度为4.0 mol·L﹣1,则此溶液中KCl 的质量分数为______
(3)从500 mL 0.2 mol/L Na2SO4 溶液中取出10 mL,取出的Na2SO4溶液物质的量浓度为___mol/L;若将这10 mL溶液用水稀释到100 mL,所得溶液中Na+的物质的量浓度为______mol/L。
(4)19g某二价金属氯化物(ACl2)中含有0.4molCl-,则ACl2的摩尔质量是______;ACl2的化学式是_________。
(5)物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液的体积比为3∶2∶1时,三种溶液中Cl-的物质的量之比为________
(6)300mL Al2(SO4)3溶液中,含Al3+为1.62g,在该溶液中加入0.1mol/L Ba(OH)2溶300mL,反应后溶液中SO42﹣的物质的量的浓度为__________(混合体积看成两液体体积之和)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图某工厂用NO气体制取NH4NO3溶液,下列说法正确的是
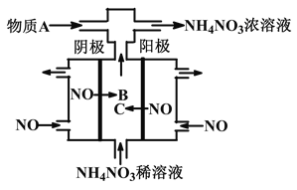
A. 阳极的电极反应式为:NO-3e-+2H2O=NO2-+4H+
B. 物质B与物质C是同一种物质
C. A物质可为氨气
D. 阴、阳两极转移的电子数之比为5∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①标准状况下,1g氢气和14g氮气的体积相同
②常温常压下,16g氧气和臭氧的混合气体中含有的质子数为8NA
③0.1L 0.5mol/LCH3CH2OH溶液中含有氢原子数为0.3NA
④常温常压下,28gCO的体积大于22.4L
⑤分子总数相等的NO2和CO2,所含氧原子数均为2NA
上述表述中正确的有:_______
(2)用容量瓶配制溶液时,由于操作不当会引起误差
①用天平称量时所用砝码生锈
②用量筒量取所需浓溶液时,仰视刻度
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,俯视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
上述情况会使所配溶液浓度偏低的是 :_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入350mL 2molL﹣1的稀硝酸恰好使混合物完全溶解,放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
A. 0.21 molB. 0.25 molC. 0.3 molD. 0.35 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com