
【题目】利用“化学计量在实验中的应用”的相关知识进行填空(设NA表示阿伏加德罗常数的值)。
(1)标准状况下,0.2 mol氨气的体积是__________, 其中含有的NH3分子数是__________,
(2) 20℃时,饱和KCl溶液的密度为0.745g·cm﹣3,物质的量浓度为4.0 mol·L﹣1,则此溶液中KCl 的质量分数为______
(3)从500 mL 0.2 mol/L Na2SO4 溶液中取出10 mL,取出的Na2SO4溶液物质的量浓度为___mol/L;若将这10 mL溶液用水稀释到100 mL,所得溶液中Na+的物质的量浓度为______mol/L。
(4)19g某二价金属氯化物(ACl2)中含有0.4molCl-,则ACl2的摩尔质量是______;ACl2的化学式是_________。
(5)物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液的体积比为3∶2∶1时,三种溶液中Cl-的物质的量之比为________
(6)300mL Al2(SO4)3溶液中,含Al3+为1.62g,在该溶液中加入0.1mol/L Ba(OH)2溶300mL,反应后溶液中SO42﹣的物质的量的浓度为__________(混合体积看成两液体体积之和)
【答案】4.48L 1.204×1023 40% 0.2 mol/L 0.04mol/L 95g/mol MgCl2 3:4:3 0.1mol/L
【解析】
根据物质的量与气体体积、物质的量的浓度等物理量之间的关系计算解答。
(1)![]() ;
;![]() ,故答案为:4.48L;1.204×1023;
,故答案为:4.48L;1.204×1023;
(2) ![]() ,故答案为:40%;
,故答案为:40%;
(3)溶液是均匀的,所以取出的Na2SO4溶液物质的量浓度为0.2 mol/L ;c(Na+)=0.2 mol/L×2=0.4 mol/L,稀释后的浓度为0.4 mol/L×1/10=0.04mol/L,故答案为:0.2 mol/L;0.04mol/L;
(4)n(ACl2)=![]() ,M(ACl2)=
,M(ACl2)=![]() ,则ACl2的摩尔质量是95g/mol;Cl的相对原子质量为35.5,则A的相对原子质量为24,则A为Mg,ACl2的化学式是MgCl2,故答案为:95g/mol;MgCl2;
,则ACl2的摩尔质量是95g/mol;Cl的相对原子质量为35.5,则A的相对原子质量为24,则A为Mg,ACl2的化学式是MgCl2,故答案为:95g/mol;MgCl2;
(5)n=cV,则三种溶液中Cl-的物质的量之比为(1×1×3):(1×2×2):(1×3×1)=3:4:3,故答案为:3:4:3;
(6)硫酸铝溶液中,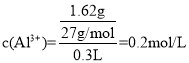 ,根据化学式知c(SO42-)=3/2c(Al3+)=
,根据化学式知c(SO42-)=3/2c(Al3+)=![]() ×0.2mol/L=0.3mol/L,n(SO42-)=0.3mol/L×0.3L=0.09mol;向该溶液中加入氢氧化钡,二者反应生成硫酸钡和水;n[Ba(OH)2]=0.1mol/L×0.3L=0.03mol,0.03mol钡离子完全反应需要0.03mol硫酸根离子,则混合溶液中剩余n(SO42-)=0.09mol-0.03mol=0.06mol,混合溶液中硫酸根离子物质的量浓度
×0.2mol/L=0.3mol/L,n(SO42-)=0.3mol/L×0.3L=0.09mol;向该溶液中加入氢氧化钡,二者反应生成硫酸钡和水;n[Ba(OH)2]=0.1mol/L×0.3L=0.03mol,0.03mol钡离子完全反应需要0.03mol硫酸根离子,则混合溶液中剩余n(SO42-)=0.09mol-0.03mol=0.06mol,混合溶液中硫酸根离子物质的量浓度![]() ,故答案为:0.1mol/L。
,故答案为:0.1mol/L。


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】对下列结构简式命名或根据名称写出结构简式:
(1)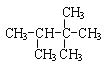 _______________________
_______________________
(2)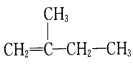 ____________________________
____________________________
(3)3—甲基—1—戊烯______________________________
(4)3,3,4-三甲基己烷______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能表示H2(g)+ I2(g)![]() 2HI(g)已经达到平衡状态的标志有几个( )
2HI(g)已经达到平衡状态的标志有几个( )
①c(H2)=c(I2)=c(HI)时②c(H2):c(I2):c(HI)=1:1:2时③c(H2)、c(I2)、c(HI)不再随时间而改变④单位时间内生成nmolH2的同时生成2nmolHI⑤单位时间内生成n mol H2的同时生成n mol I2⑥反应速v(H2)=v(I2)=1/2v(HI)⑦一个H-H键断裂的同时有两个H-I键断裂⑧温度和体积一定时,容器内压强不再变化⑨温度和体积一定时,混合气体的颜色不再变化⑩温度和压强一定时,混合气体的密度不再变化条件一定,混合气体的平均相对分子质量不再变化
A. 3B. 4C. 5D. 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把aL含硫酸铵和硝酸铵的混合液分成两等份,一份需用b mol烧碱刚好把铵根离子全部赶出,另一份与氯化钡溶液反应时,消耗c mol氯化钡,由此可知原溶液中NO3—的物质的量浓度是(单位:mol·L—1) ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为:KClO3+HCl(浓)== KCl+ClO2↑+Cl2↑+。
(1)请 写出完整的化学方程式并配平_______。
(2)浓盐酸在反应中显示出来的性质是_______(填写编号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)用双线桥法标明电子转移的方向和数目____。
(4)产生0.1molCl2,则转移的电子的物质的量为___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
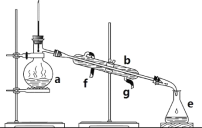
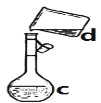
(1)写出下列仪器的名称:a.____________,b.___________,
(2)若利用装置分离四氯化碳和酒精的混合物,还缺少的仪器是__________,将仪器补充完整后进行实验,温度计水银球的位置在______处。
Ⅱ.配制一定物质的量浓度的溶液是化学实验室的基本实验操作之一。请回答下列问题:
(3)配制0.5 mol/L的硫酸溶液450 mL,需用量筒量取质量分数98%、密度1.84 g/cm3的浓硫酸的体积为_____mL,如果实验室有15 mL、20 mL、50 mL 量筒,应最好选用_____mL量筒。
(4)配制上述溶液,除用到量筒、烧杯、玻璃棒外,还需要的两种玻璃仪器是_____、_______。
(5)配制时,其正确的操作顺序是__________(用字母表示,每个操作只用一次)。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有水的烧杯中加入浓硫酸稀释
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
(6)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)。若没有进行A操作___________;若定容时俯视刻度线_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL,下列叙述不正确的是( )

A.某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。则烧杯的实际质量为27.4 g
B.要完成本实验该同学应称出10.0g NaOH
C.氢氧化钠固体溶解后必须恢复至室温再进行转移
D.容量瓶使用前需洗涤、并保持干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计如下实验分别测定氮化铝(AlN样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理:①Al4C3与硫酸反应可生成CH4;
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程式:____________。
(2)实验装置(如图所示,量气管为碱式滴定管改装)
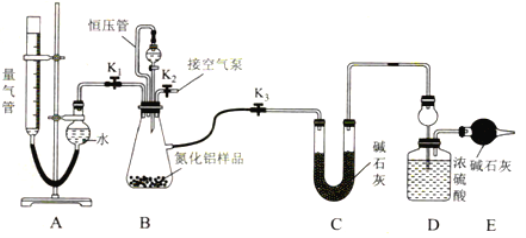
连好装置后,首先应进行的操作是________。
(3)实验过程:称得装置D的初始质量为y g;称取x g AlN样品置于装置B锥形瓶中,各装置中加入相应药品,重新连好装置;读取量气管的初始读数为a mL(量气装置左右液面相平)。
①欲首先测量Al4C3质量分数的有关数据,对三个活塞的操作是________。
②若无恒压管,对所测气体体积的影响是________(填“偏大”“偏小”或“无影响”)
③量气管中液面不再发生变化,说明反应已经结束。读取读数之前,应对量气管进行调整量气管高度,使左右两边液面相平 ,若量气管中的液面高于右侧球形容器中的液面,所测气体的体积______(填“偏大”“偏小”或“无影响”)。
④记录滴定管的读数为b mL(已知:该实验条件下的气体摩尔体积为Vm L·mol-1),则Al4C3的质量分数为______(用含a、b、x、y、Vm的代数式表示)。
⑤测量AlN质量分数的数据:首先关闭活塞 K1 ,打开活塞K3,通过分液漏斗加入过量___,与装置B瓶内物质充分反应;反应完成后,____(填入该步应进行的操作),最后称得装置D的质量为z g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种降血压药物H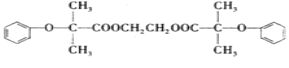 可由下列路线合成:
可由下列路线合成:
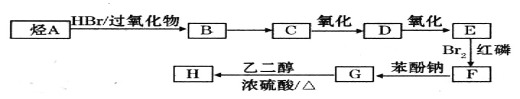
已知:
I.RCH=CH2 ![]() RCH2CH2Br
RCH2CH2Br
II.RCH2COOH![]()
回答下列问题:
(1)A的名称为______________。
(2)B→C的反应条件为_______________,E→F的反应类型为_______________。
(3)D结构简式为______________。
(4)与C同类别的同分异构体有_________种(不含C),其中核磁共振氢谱中面积比最大的是_________(写结构简式)。
(5)G→H的化学方程式为_________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com